臨床成績
海外第III相臨床試験
(Cx601-0302試験;検証試験)(海外データ)7~9)
アロフィセル.jp 医療関係者向けTOP > アロフィセルの基本情報:臨床成績 > 海外第III相臨床試験(Cx601-0302試験;検証試験)(海外データ)
海外第III相試験
(Cx601-0302試験;検証試験)(海外データ)7~9)
本臨床試験には事後解析結果(104週)が含まれていますが、臨床成績の安全性部分に関してのみ、安全性情報を網羅的に伝達する目的で事後解析結果の情報も掲載しています。
7)クローン病に伴う複雑痔瘻を対象とした海外第III相臨床試験成績 (社内資料、承認審査時評価資料)
8)Panés J, et al.: Lancet. 2016; 388(10051): 1281-1290.
本試験はTiGenix社(現Takeda)が実施しているものであり、本論文の著者のうち2名は同社の社員である。
著者に同社よりコンサルタント料等を受領している者が含まれる。
9)Panés J, et al.: Gastroenterology. 2018; 154(5): 1334-1342.
本試験はTiGenix社(現Takeda)が実施しているものであり、本論文の著者のうち4名は同社の社員である。
著者に同社よりコンサルタント料等を受領している者が含まれる。
試験概要
| 目的 | クローン病患者の複雑痔瘻治療におけるダルバドストロセルの有効性及び安全性を24週間及び最長104週間の延長追跡調査期間にわたりプラセボと比較する。 |
|---|---|
| 試験 デザイン |
多施設共同、無作為化、二重盲検、並行群間比較、プラセボ対照試験 |
| 対象 | クローン病に伴う複雑痔瘻を有する患者で、以下を満たす患者
|
| 例数 | 212例(ダルバドストロセル群107例、プラセボ群105例)(ITT解析対象集団) 205例(ダルバドストロセル群103例、プラセボ群102例)(安全性解析対象集団) |
| 主な 選択基準 |
(1) 複雑痔瘻を有しており、臨床的評価及びMRIにより原発口が2つ以下、二次口が3つ以下であることが確認された者。瘻孔は組入れの6週間以上前から排膿がみられること。複雑痔瘻は、次の1つ以上の基準にあてはまる場合と定義する:
|
| 主な 除外基準 |
(1) 直ちに治療が必要な活動期のクローン病を有する者 (2) 直腸膣瘻を合併する者 (3) 痔瘻の治療(抗菌薬、免疫調節薬又は抗TNFα抗体製剤)を受けたことがない者 (4) 2cmを超える膿瘍又は液貯留がある者(前処置によって消失した場合を除く) (5) 直腸若しくは肛門の狭窄、又は活動性直腸炎を有する者(外科的手術の妨げとなる場合) (6) 治療対象の瘻孔に対し、ドレナージ又はシートン留置以外の外科的手術を受けた者 (7) 人工肛門を有する者 |
| 投与方法・ 投与量及び 投与期間 |
治験製品投与前の5週間をスクリーニング期とし、適格性を判定した。さらに、投与2週間前までに前処置(麻酔下での診察及び瘻孔掻爬、臨床的に必要とされた場合にはシートン留置)を行った。シートン留置を行った場合、投与直前に抜去した。 対象患者をダルバドストロセル群又はプラセボ群に1:1の比で無作為割付し、120×106個のeASCを含む細胞懸濁液24mL(5×106個/mL)又はプラセボ(生理食塩液)を病変内に単回投与した。なお、本試験では前治療(抗TNFα抗体製剤、免疫調節薬等)の継続を許容しており、投与群間で前治療の併用状況のバランスをとるため、抗TNFα抗体製剤及び免疫調節薬の併用の有無による層別割付を実施した。投与24週後に主要評価項目を評価し、その後、同意した被験者については、52週、104週までの延長追跡調査を実施し、有効性及び安全性の評価を行った。 |
試験デザイン
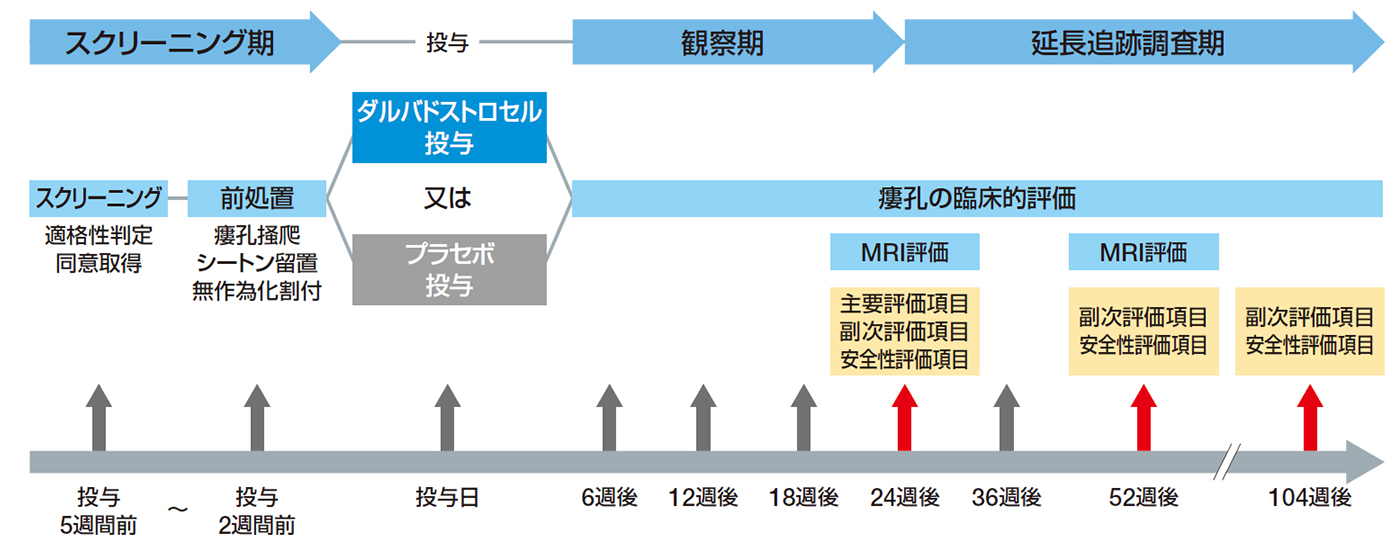
| 主要 評価項目 |
24週後の複合寛解注1)率(検証項目) |
|---|---|
| 副次 評価項目 |
〈重要な副次評価項目〉 24週後の臨床寛解注2)率、改善注3)率 〈その他の副次評価項目〉 52週後の複合寛解注1)率、改善注3)率、52週後及び104週後の臨床寛解注2)率、24週後及び52週後以前の複合寛解までの期間注5)、臨床寛解までの期間注5)、改善までの期間注5)、24週後、52週後及び104週後の再発注4)率、24週後、52週後及び104週後以前の再発までの期間注6)、24週後、52週後及び104週後までのPDAIスコア、CDAIスコア、IBDQスコアによるQoL評価、24週後及び52週後までのVan Asscheスコア |
| 安全性 評価項目 |
有害事象(重篤な有害事象、特に注目すべき有害事象を含む)、診察所見、バイタルサイン、臨床検査値(血液生化学検査、血液学的検査) |
| 解析計画 | 主要評価項目については、投与群別に集計し、有意水準を両側0.025として、無作為化時の層別因子で調整したCochran-Mantel-Haenszel検定を行った。また、ベースラインにおける抗TNFα抗体製剤及び免疫調節薬の併用の有無別のサブグループ解析を行った。臨床評価又はMRIデータの欠測がある場合は、LOCFを適用しベースライン以降の最終時点の値を代入した。 有害事象については、MedDRA Ver.17.0(24週後)又はVer.18.0(52週後、104週後)を用いて投与群別及び解析対象集団全体で要約した。バイタルサインについては、観測値及びベースラインからの変化量を投与群別及び評価時点別に要約した。臨床検査値については、各パラメータの結果を投与群別及び評価時点別に要約した。 |
注1)複合寛解:ベースライン時に排膿があり、治験製品を投与したすべての二次口が軽い指押しを行っても排膿がみられず閉鎖したと臨床的に確認され、かつ、治験製品を投与した瘻孔内に2cmを超える膿瘍がないことがMRI画像の中央判定*1で確認された場合
注2)臨床寛解:ベースライン時に排膿があり、治験製品を投与したすべての二次口が軽い指押しを行っても排膿がみられず閉鎖したと臨床的に確認された場合
注3)改善:ベースライン時に排膿があり、治験製品を投与した二次口のうちの50%以上が軽い指押しを行っても排膿がみられず閉鎖したと臨床的に確認された場合
注4)再発:24週評価時は24週後より前に臨床寛解を達成した被験者、52週評価時及び104週評価時は24週後及び52週後時点で複合寛解を達成した被験者において、治験製品を投与した二次口のいずれかで排膿を伴う再開通が臨床的に確認された場合、又は治験製品を投与した瘻孔内に2cmを超える膿瘍がMRI画像の中央判定*1で確認された場合
注5)複合寛解/臨床寛解/改善までの期間:治験製品の投与から、複合寛解/臨床寛解/改善がみられた最初の来院日までの期間
注6)再発までの期間:24週評価時は24週後より前に臨床寛解を達成した被験者において臨床寛解がみられた最初の来院日、52週評価時及び104週評価時はそれぞれ24週後及び52週後時点で複合寛解を達成した被験者において複合寛解がみられた来院日から、再発*2がみられた最初の来院日までの期間
*1 本試験では、盲検化のため投与群及び撮影時点を示さない状態で判定した。
*2 各評価時点の再発の定義に基づく。
[CDAI]クローン病活動性指数、[CI]信頼区間、[eASC]ヒト(同種)脂肪組織由来幹細胞、[IBDQ]炎症性腸疾患質問票、[LOCF]last observation carried forward、[PDAI]肛門周囲病変活動性指数、[TNF]腫瘍壊死因子
患者背景
| 項目 | カテゴリ | ダルバドストロセル群 (n=107) |
プラセボ群 (n=105) |
合計 (n=212) |
|---|---|---|---|---|
| 性別 [例数(%)] |
男性 | 60 (56.1) |
56 (53.3) |
116 (54.7) |
| 女性 | 47 (43.9) |
49 (46.7) |
96 (45.3) |
|
| 年齢(歳) | 平均値± 標準偏差 |
39.0± 13.11 |
37.6± 13.12 |
38.3± 13.10 |
| 最小値、 最大値 |
18.0、 74.0 |
19.0、 73.0 |
18.0、 74.0 |
|
| 年齢(歳) [例数(%)] |
≦65 | 104 (97.2) |
101 (96.2) |
205 (96.7) |
| 66~75 | 3 (2.8) |
4 (3.8) |
7 (3.3) |
|
| 76~85 | 0 | 0 | 0 | |
| ≧85 | 0 | 0 | 0 | |
| 人種 [例数(%)] |
白人 | 100 (93.5) |
96 (91.4) |
196 (92.5) |
| 黒人 | 4 (3.7) |
1 (1.0) |
5 (2.4) |
|
| アジア人 | 0 | 0 | 0 | |
| その他 | 0 | 1 (1.0) |
1 (0.5) |
|
| 報告なし | 3 (2.8) |
7 (6.7) |
10 (4.7) |
|
| 体重(kg) | 平均値± 標準偏差 |
73.93± 15.006 |
71.33± 14.922 |
72.64± 14.985 |
| ベースライン における 抗TNFα抗体製剤 及び 免疫調節薬 併用 [例数(%)] |
抗TNFα抗体製剤 のみ併用 |
37 (34.6) |
33 (31.4) |
70 (33.0) |
| 免疫調節薬 のみ併用 |
16 (15.0) |
22 (21.0) |
38 (17.9) |
|
| 抗TNFα抗体製剤+ 免疫調節薬併用 |
28 (26.2) |
31 (29.5) |
59 (27.8) |
|
| いずれも 併用なし |
26 (24.3) |
19 (18.1) |
45 (21.2) |
|
| クローン病の 罹病期間(年)注1) |
例数 | 106 | 105 | 211 |
| 平均値± 標準偏差 |
12.1± 10.0 |
11.3± 8.9 |
11.7± 9.5 |
|
| 最小値、 最大値 |
0.5、 48.8 |
0.5、 36.4 |
0.5、 48.8 |
|
| クローン病の 前治療歴 (過去6ヵ月 以内) [例数(%)] |
例数 | 98 (91.6) |
99 (94.3) |
197 (92.9) |
| 抗菌薬 治療歴あり注2) |
82 (76.6) |
74 (70.5) |
156 (73.6) |
|
| 免疫調節薬 治療歴あり注3) |
89 (83.2) |
77 (73.3) |
166 (78.3) |
|
| 抗TNFα抗体製剤 治療歴あり注4) |
83 (77.6) |
84 (80.0) |
167 (78.8) |
|
| ベースライン における PDAIスコア注5) |
平均値± 標準偏差 |
6.77± 2.475 |
6.55± 2.919 |
― |
| 最小値、 最大値 |
0、 16.0 |
2.0、 14.0 |
― | |
| ベースライン における CDAIスコア注5) |
平均値± 標準偏差 |
88.74± 48.835 |
94.21± 58.695 |
― |
| 最小値、 最大値 |
17.0、 219.0 |
11.0、 304.0 |
― | |
| ベースライン における Van Assche スコア注5) |
平均値± 標準偏差 |
9.02± 3.558 |
9.20± 3.657 |
― |
| 最小値、 最大値 |
3.0、 20.0 |
3.0、 18.0 |
― | |
| ベースライン における IBDQスコア注5) |
平均値± 標準偏差 |
174.06± 31.151 |
169.05± 36.688 |
― |
| 最小値、 最大値 |
99.0、 219.0 |
52.0、 219.0 |
― | |
| 原発口の数 [例数(%)] |
なし | 0 | 1 (1.0) |
1 (0.5) |
| 1つ | 82 (76.6) |
90 (85.7) |
172 (81.1) |
|
| 2つ | 21 (19.6) |
11 (10.5) |
32 (15.1) |
|
| 二次口の数 [例数(%)] |
1つ | 58 (54.2) |
73 (69.5) |
131 (61.8) |
| 2つ | 37 (34.6) |
25 (23.8) |
62 (29.2) |
|
| 3つ以上 | 8 (7.5) |
4 (3.8) |
12 (5.7) |
|
| 原発口及び 二次口の数 [例数(%)] |
原発口なし、 二次口が1つ |
0 | 1 (1.0) |
1 (0.5) |
| 原発口が1つ、 二次口が1つ |
55 (51.4) |
70 (66.7) |
125 (59.0) |
|
| 原発口が1つ、 二次口が2つ |
23 (21.5) |
17 (16.2) |
40 (18.9) |
|
| 原発口が1つ、 二次口が3つ |
4 (3.7) |
3 (2.9) |
7 (3.3) |
|
| 原発口が2つ、 二次口が1つ |
3 (2.8) |
2 (1.9) |
5 (2.4) |
|
| 原発口が2つ、 二次口が2つ |
14 (13.1) |
8 (7.6) |
22 (10.4) |
|
| 原発口が2つ、 二次口が3つ |
4 (3.7) |
1 (1.0) |
5 (2.4) |
注1)(同意取得日-診断日)/365.25により算出した。
注2)抗菌薬の全身性投与(経口投与、静脈内注射又は筋肉内注射)。
注3)アザチオプリンは2~2.5mg/kg、6-メルカプトプリンは1~1.5mg/kgの用量での投与。
注4)一定用量での抗TNFα抗体製剤の投与。
注5)ベースラインは治験製品投与前の最終時点の値と定義した。
※6-メルカプトプリン(ロイケリン散10%)はクローン病への適応はありません。
有効性
24週後の複合寛解率(主要評価項目)(検証項目)
52週後の複合寛解率(その他の副次評価項目)
24週後の複合寛解率は、ダルバドストロセル群で49.5%、プラセボ群で34.3%であった。投与群間差[97.5%CI]は15.2%[0.2, 30.3]、投与群間差のp値は0.024であり、ダルバドストロセル群のプラセボ群に対する優越性が検証された(無作為化時の層別因子で調整したCochran-Mantel-Haenszel検定)。
また、52週後の複合寛解率は、ダルバドストロセル群で54.2%、プラセボ群で37.1%であった。投与群間差[95%CI]は17.1%[3.9, 30.3]であり、統計学的に有意な差がみられた(p=0.012、無作為化時の層別因子で調整したCochran-Mantel-Haenszel検定、名目上のp値)。
24週後の複合寛解率(検証項目)及び52週後の複合寛解率(ITT解析対象集団)
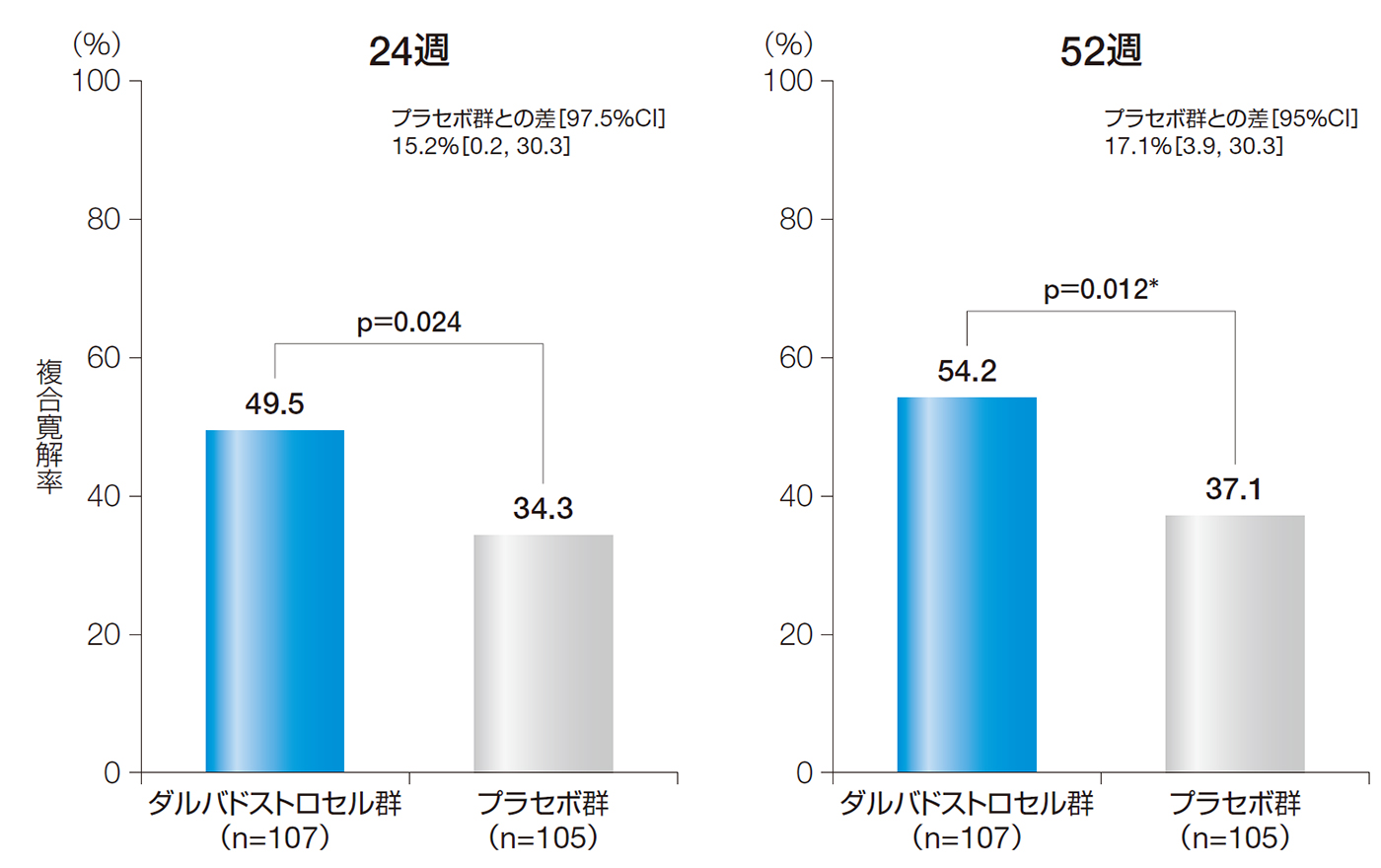
無作為化時の層別因子(抗TNFα抗体製剤又は免疫調節薬の併用の有無)で調整したCochran-Mantel-Haenszel検定
*名目上のp値
【複合寛解】
ベースライン時に排膿があり、治験製品を投与したすべての二次口が軽い指押しを行っても排膿がみられず閉鎖したと臨床的に確認され、かつ、治験製品を投与した瘻孔内に2cmを超える膿瘍がないことがMRI画像の中央判定で確認された場合。
24週後以前の複合寛解までの期間(その他の副次評価項目)
24週後以前の複合寛解までの期間の中央値[95%CI]は、ダルバドストロセル群で25.0週[24.7, 26.1]、プラセボ群で28.1週[24.7, 36.0]であった。
24週後以前の複合寛解までの期間(ITT解析対象集団)
| ダルバドストロセル群 (n=107) |
プラセボ群 (n=105) |
|
|---|---|---|
| 24週後で 複合寛解 (主要評価項目) (検証項目) [例数(%)] |
53 (49.5) |
36 (34.3) |
| 24週後までに 複合寛解が 得られず 打ち切り [例数(%)] |
54 (50.5) |
69 (65.7) |
| Kaplan-Meier 法による 複合寛解 までの期間注) 中央値[95%CI] (週) |
25.0 [24.7, 26.1] |
28.1 [24.7, 36.0] |
注)投与されなかった被験者は時間0での打ち切りとした。
【複合寛解までの期間】
治験製品の投与から、複合寛解がみられた最初の来院日までの期間。
24週後の臨床寛解率(重要な副次評価項目)
52週後の臨床寛解率(その他の副次評価項目)
24週後の臨床寛解率は、ダルバドストロセル群で53.3%、プラセボ群で41.0%であった。投与群間差[95%CI]は12.3%[−1.0, 25.7]であり、統計学的に有意な差はみられなかった(p=0.064、無作為化時の層別因子で調整したCochran-Mantel-Haenszel検定、名目上のp値)。
また、52週後の臨床寛解率は、ダルバドストロセル群で57.0%、プラセボ群で40.0%であった。投与群間差[95%CI]は17.0%[3.8, 30.3]であり、統計学的に有意な差がみられた(p=0.016、無作為化時の層別因子で調整したCochran-Mantel-Haenszel検定、名目上のp値)。
24週後及び52週後の臨床寛解率(ITT解析対象集団)
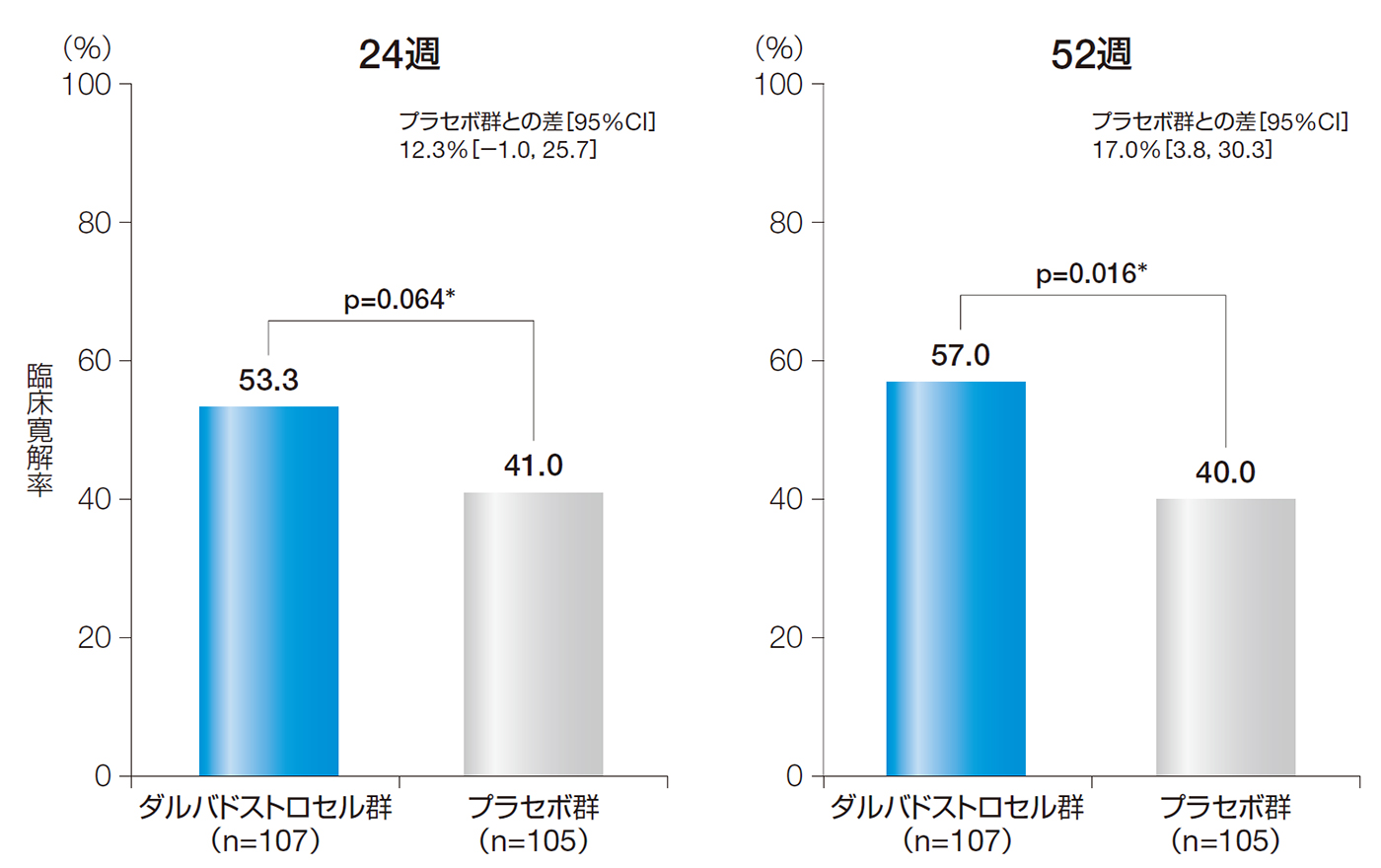
無作為化時の層別因子(抗TNFα抗体製剤又は免疫調節薬の併用の有無)で調整したCochran-Mantel-Haenszel検定
*名目上のp値
【臨床寛解】
ベースライン時に排膿があり、治験製品を投与したすべての二次口が軽い指押しを行っても排膿がみられず閉鎖したと臨床的に確認された場合。
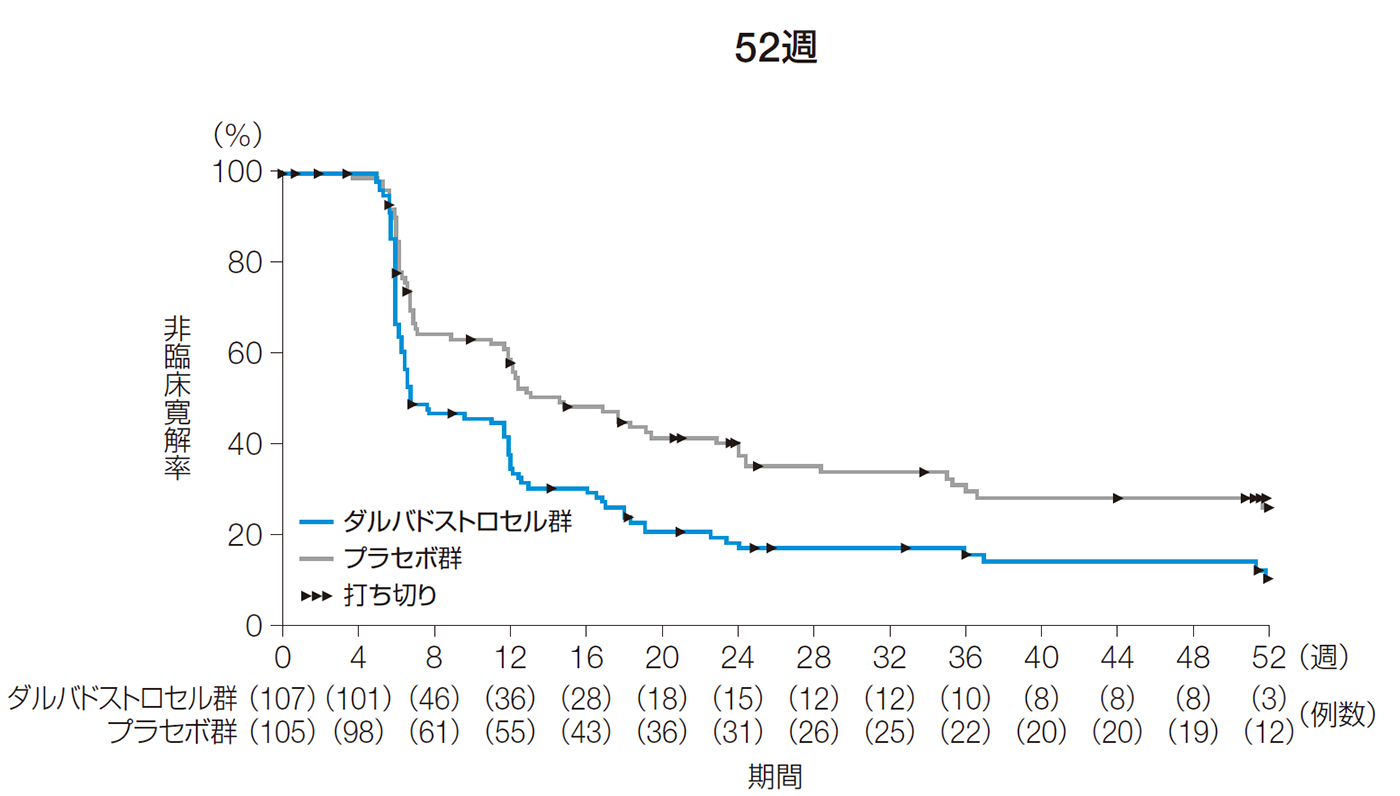
24週後及び52週後以前の臨床寛解までの期間(その他の副次評価項目)
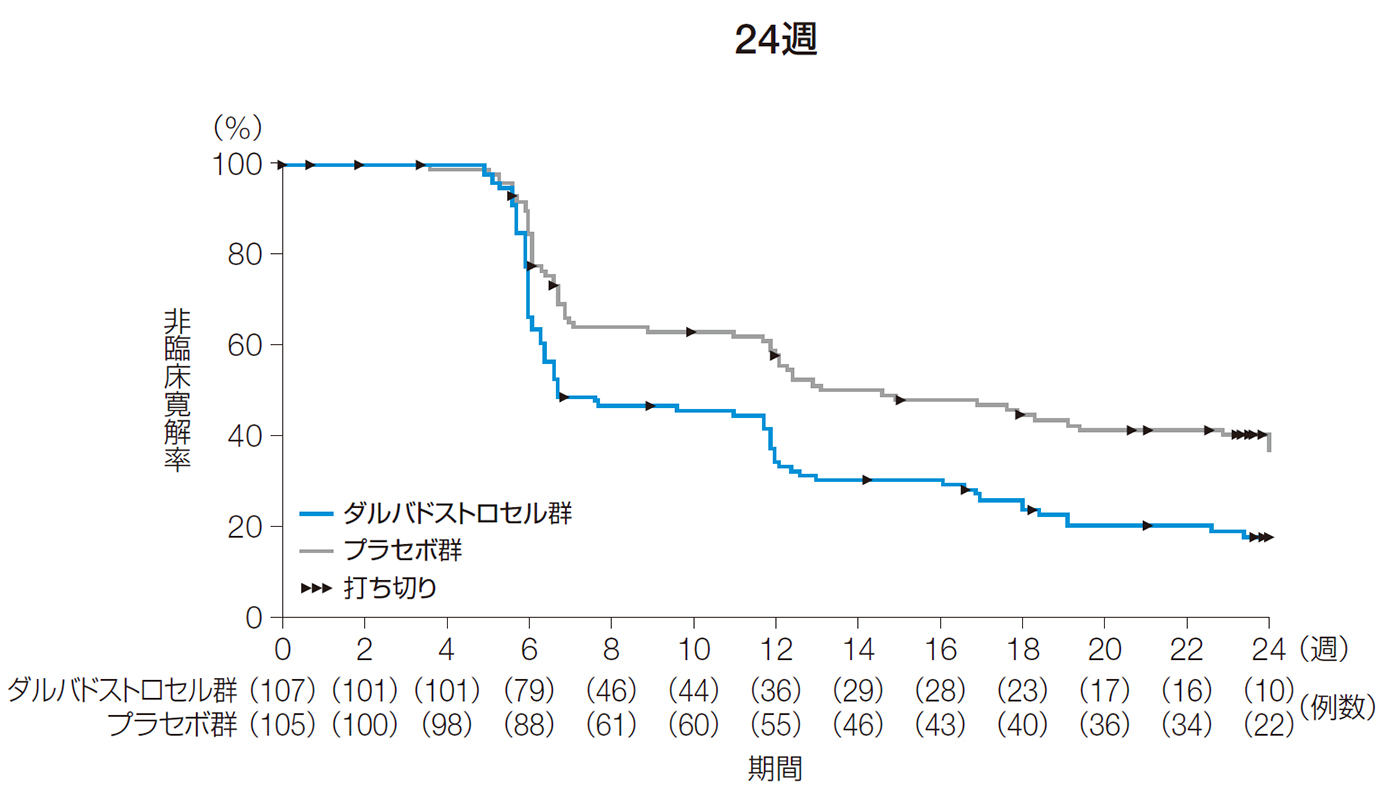
24週後以前の臨床寛解までの期間の中央値[95%CI]は、ダルバドストロセル群で6.7週[6.4, 11.9]、プラセボ群で14.6週[11.9, 22.9]であった。
また、52週後以前の臨床寛解までの期間の中央値[95%CI]は、ダルバドストロセル群で6.7週[6.4, 11.9]、プラセボ群で14.6週[11.9, 22.9]であった。
24週後及び52週後以前の臨床寛解までの期間(ITT解析対象集団)
| ダルバドストロセル群 (n=107) |
プラセボ群 (n=105) |
|
|---|---|---|
| 24週後までに 臨床寛解 [例数(%)] |
82 (76.6) |
62 (59.0) |
| 24週後までに 臨床寛解が 得られず 打ち切り [例数(%)] |
25 (23.4) |
43 (41.0) |
| Kaplan-Meier 法による 臨床寛解 までの期間注) 中央値[95%CI] (週) |
6.7 (6.4, 11.9) |
14.6 (11.9, 22.9) |
| ダルバドストロセル群 (n=107) |
プラセボ群 (n=105) |
|
|---|---|---|
| 52週後までに 臨床寛解 [例数(%)] |
86 (80.4) |
69 (65.7) |
| 52週後までに 臨床寛解が 得られず 打ち切り [例数(%)] |
21 (19.6) |
36 (34.3) |
| Kaplan-Meier 法による 臨床寛解 までの期間注) 中央値[95%CI] (週) |
6.7 (6.4, 11.9) |
14.6 (11.9, 22.9) |
注)投与されなかった被験者は時間0での打ち切りとした。
【臨床寛解までの期間】
治験製品の投与から、臨床寛解がみられた最初の来院日までの期間。
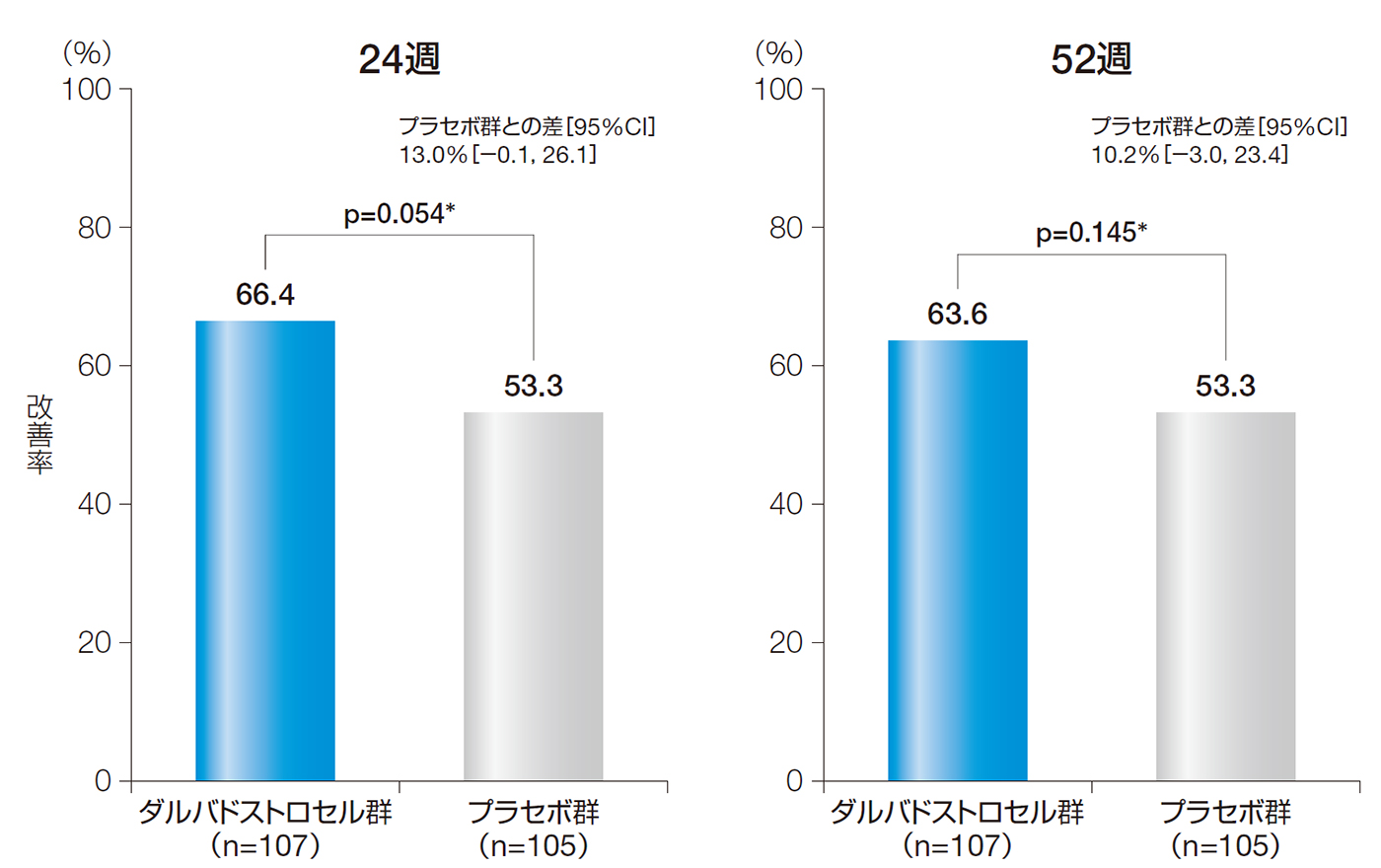
24週後の改善率(重要な副次評価項目)
52週後の改善率(その他の副次評価項目)
24週後の改善率は、ダルバドストロセル群で66.4%、プラセボ群で53.3%であった。投与群間差[95%CI]は13.0%[−0.1, 26.1]であり、統計学的に有意な差はみられなかった(p=0.054、無作為化時の層別因子で調整したCochran-Mantel-Haenszel検定、名目上のp値)。
また、52週後の改善率は、ダルバドストロセル群で63.6%、プラセボ群で53.3%であった。投与群間差[95%CI]は10.2%[−3.0, 23.4]であり、統計学的に有意な差はみられなかった(p=0.145、無作為化時の層別因子で調整したCochran-Mantel-Haenszel検定、名目上のp値)。
24週後及び52週後の改善率(ITT解析対象集団)
無作為化時の層別因子(抗TNFα抗体製剤又は免疫調節薬の併用の有無)で調整したCochran-Mantel-Haenszel検定
*名目上のp値
【改善】
ベースライン時に排膿があり、治験製品を投与した二次口のうちの50%以上が軽い指押しを行っても排膿がみられず閉鎖したと臨床的に確認された場合。
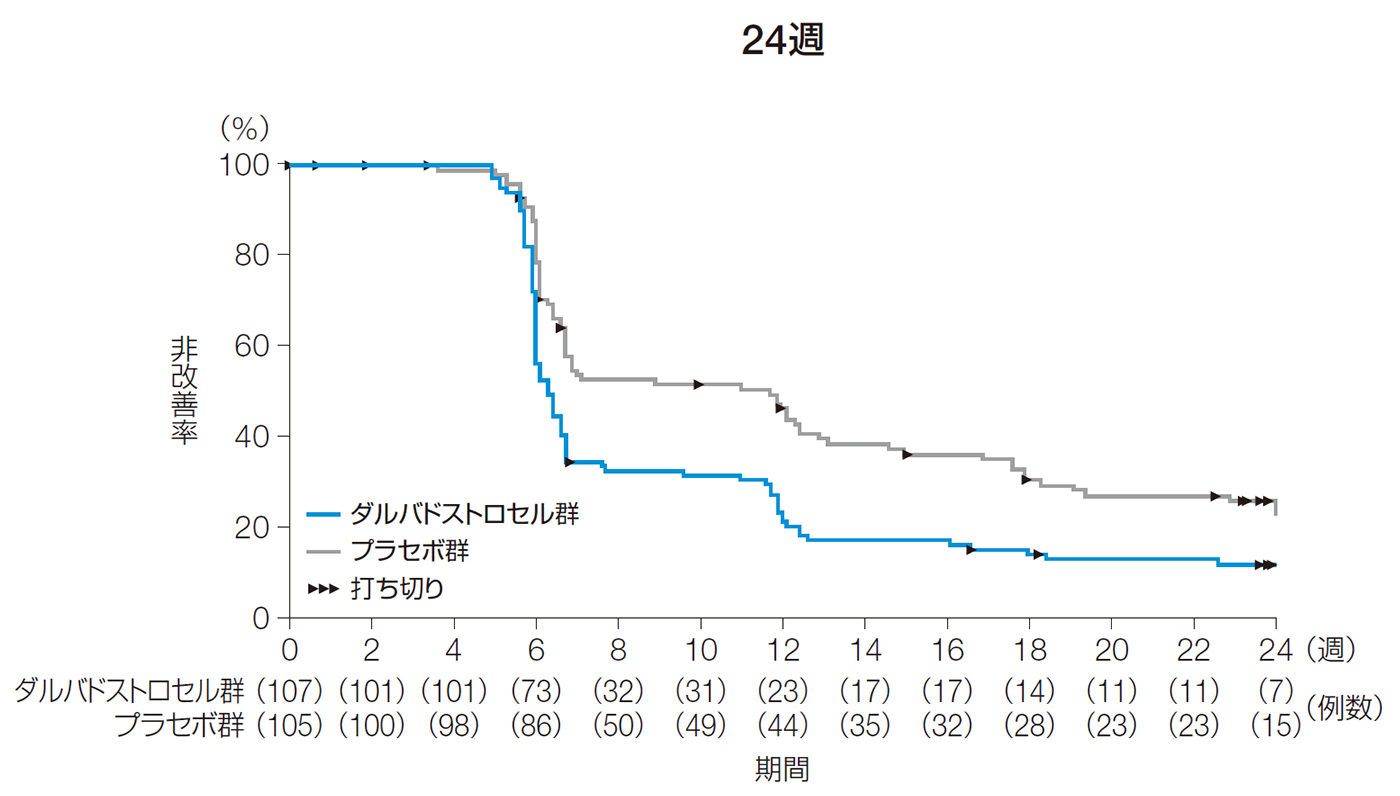
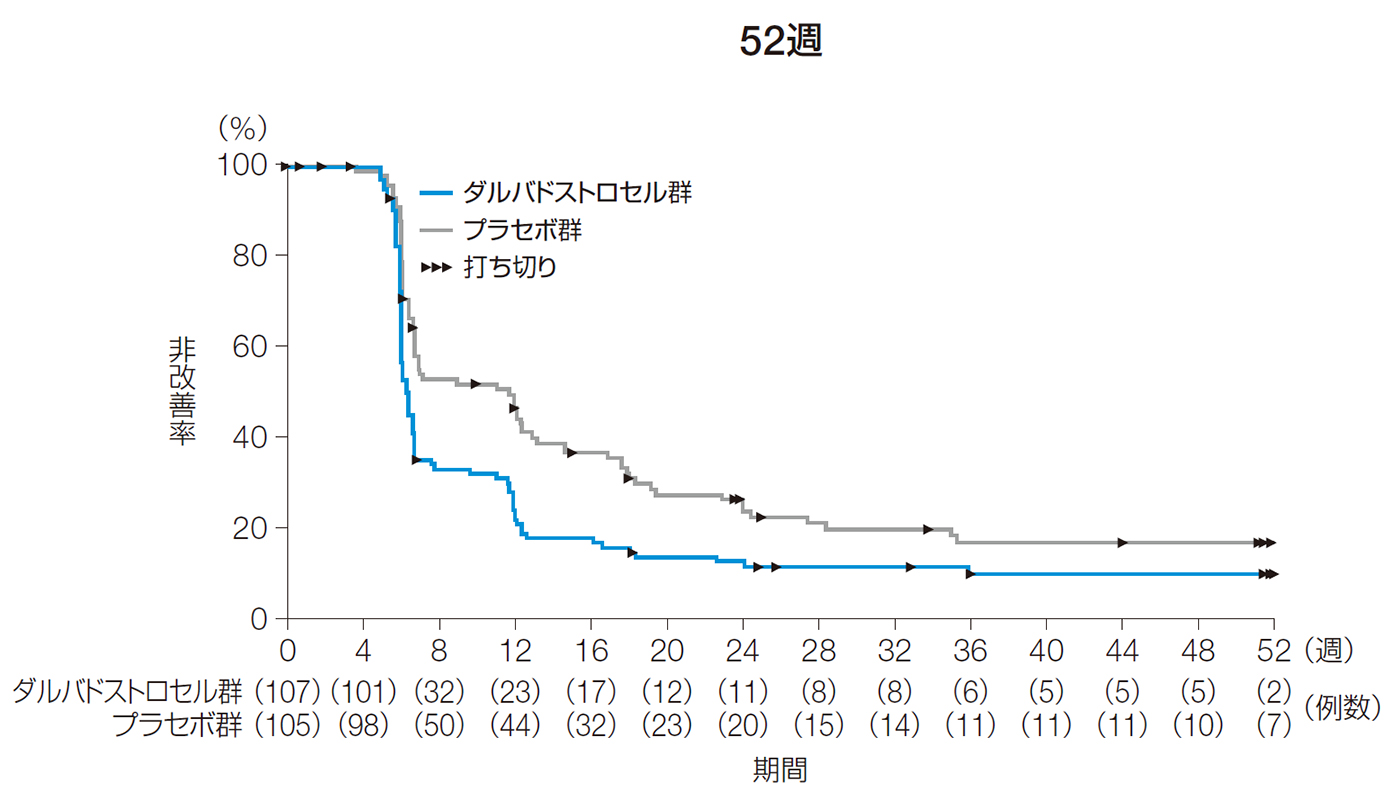
24週後及び52週後以前の改善までの期間(その他の副次評価項目)
24週後以前の改善までの期間の中央値[95%CI]は、ダルバドストロセル群で6.3週[6.0, 6.6]、プラセボ群で11.7週[6.7, 12.9]であった。
また、52週後以前の改善までの期間の中央値[95%CI]は、ダルバドストロセル群で6.3週[6.0, 6.6]、プラセボ群で11.7週[6.7, 12.9]であった。
24週後及び52週後以前の改善までの期間(ITT解析対象集団)
| ダルバドストロセル群 (n=107) |
プラセボ群 (n=105) |
|
|---|---|---|
| 24週後までに 改善 [例数(%)] |
89 (83.2) |
75 (71.4) |
| 24週後までに 改善が 得られず 打ち切り [例数(%)] |
18 (16.8) |
30 (28.6) |
| Kaplan-Meier 法による 改善 までの期間注) 中央値[95%CI] (週) |
6.3 (6.0, 6.6) |
11.7 (6.7, 12.9) |
| ダルバドストロセル群 (n=107) |
プラセボ群 (n=105) |
|
|---|---|---|
| 52週後までに 改善 [例数(%)] |
90 (84.1) |
79 (75.2) |
| 52週後までに 改善 得られず 打ち切り [例数(%)] |
17 (15.9) |
26 (24.8) |
| Kaplan-Meier 法による 改善 までの期間注) 中央値[95%CI] (週) |
6.3 (6.0, 6.6) |
11.7 (6.7, 12.9) |
注)投与されなかった被験者は時間0での打ち切りとした。
【改善までの期間】
治験製品の投与から、改善がみられた最初の来院日までの期間。
抗TNFα抗体製剤及び免疫調節薬併用状況別の24週後の複合寛解率
(主要評価項目のサブグループ解析)
抗TNFα抗体製剤及び免疫調節薬併用状況別の24週後の臨床寛解率及び改善率
(重要な副次評価項目のサブグループ解析)
抗TNFα抗体製剤及び免疫調節薬併用状況別の24週後の複合寛解率、臨床寛解率及び改善率は以下のとおりであった。
抗TNFα抗体製剤及び免疫調節薬併用状況別の24週後の複合寛解率、臨床寛解率及び改善率(ITT解析対象集団、サブグループ解析)
ダルバドストロセル群
| 無作為化来院時 の併用薬 |
複合寛解 例数(%) |
臨床寛解 例数(%) |
改善 例数(%) |
|---|---|---|---|
| 抗TNFα抗体製剤のみ (n=37) |
17 (45.9) |
18 (48.6) |
24 (64.9) |
| 免疫調節薬のみ (n=16) |
5 (31.3) |
6 (37.5) |
8 (50.0) |
| 抗TNFα抗体製剤+ 免疫調節薬 (n=28) |
18 (64.3) |
19 (67.9) |
21 (75.0) |
| いずれも併用なし (n=26) |
13 (50.0) |
14 (53.8) |
18 (69.2) |
プラセボ群
| 無作為化来院時 の併用薬 |
複合寛解 例数(%) |
臨床寛解 例数(%) |
改善 例数(%) |
|---|---|---|---|
| 抗TNFα抗体製剤のみ (n=33) |
12 (36.4) |
13 (39.4) |
17 (51.5) |
| 免疫調節薬のみ (n=22) |
6 (27.3) |
7 (31.8) |
11 (50.0) |
| 抗TNFα抗体製剤+ 免疫調節薬 (n=31) |
14 (45.2) |
18 (58.1) |
20 (64.5) |
| いずれも併用なし (n=19) |
4 (21.1) |
5 (26.3) |
8 (42.1) |
臨床評価又はMRIデータの欠測がある場合は、LOCFを適用しベースライン以降の最終時点の値を代入した。
【複合寛解】
ベースライン時に排膿があり、治験製品を投与したすべての二次口が軽い指押しを行っても排膿がみられず閉鎖したと臨床的に確認され、かつ、治験製品を投与した瘻孔内に2cmを超える膿瘍がないことがMRI画像の中央判定で確認された場合。
【臨床寛解】
ベースライン時に排膿があり、治験製品を投与したすべての二次口が軽い指押しを行っても排膿がみられず閉鎖したと臨床的に確認された場合。
【改善】
ベースライン時に排膿があり、治験製品を投与した二次口のうちの50%以上が軽い指押しを行っても排膿がみられず閉鎖したと臨床的に確認された場合。
24週後及び52週後の再発率(その他の副次評価項目)
24週後及び52週後の再発率は、ダルバドストロセル群でそれぞれ38.0%及び25.0%、プラセボ群でそれぞれ50.0%及び44.1%であり、投与群間差[95%CI]はそれぞれ−12.0%[−28.9, 4.9]及び−19.1%[−39.5, 1.3]であった。
24週後及び52週後の再発率(ITT解析対象集団)
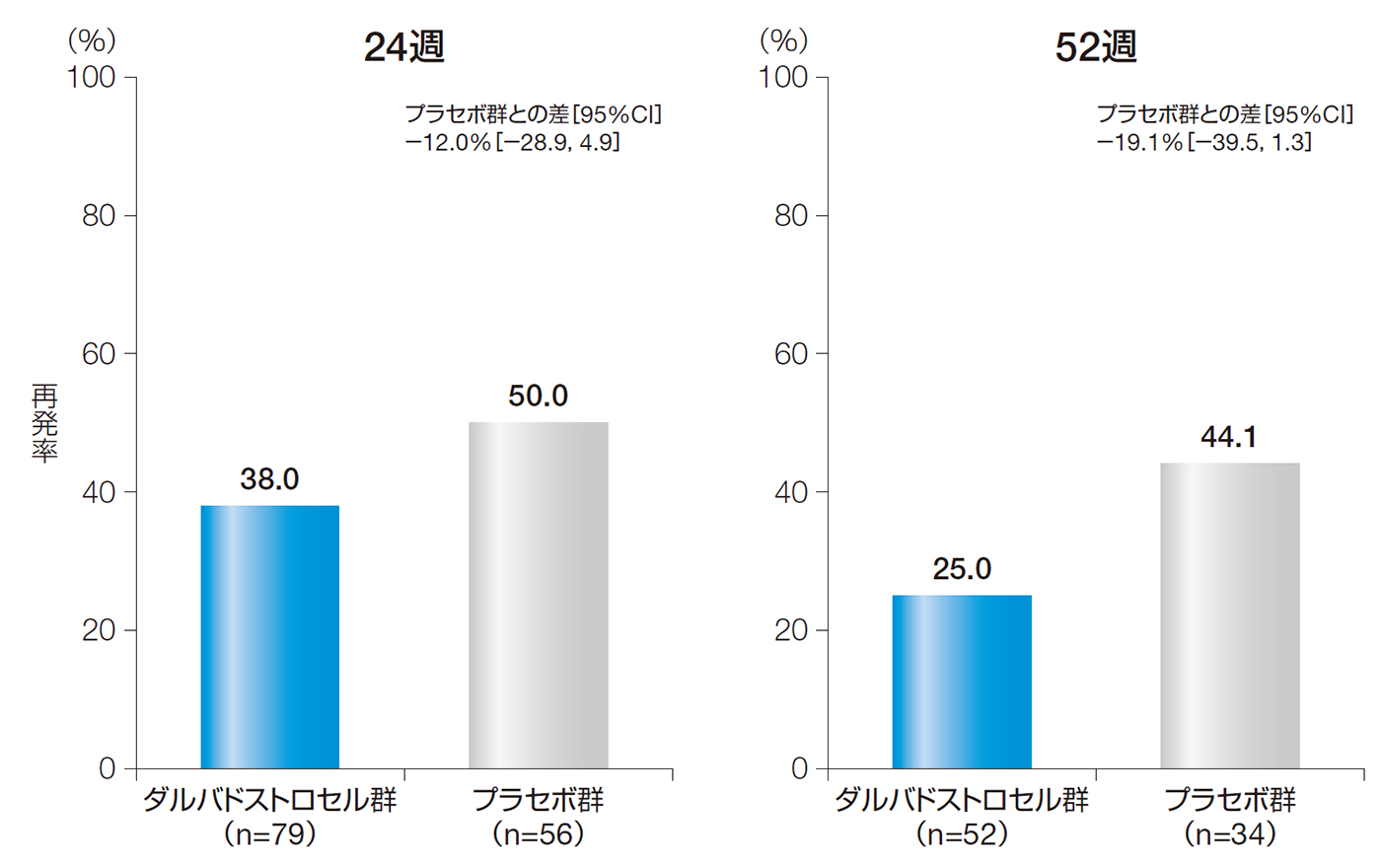
【再発】
24週評価時は24週後より前に臨床寛解を達成した被験者、52週評価時は24週後時点で複合寛解を達成した被験者において、治験製品を投与した二次口のいずれかで排膿を伴う再開通が臨床的に確認された場合、又は治験製品を投与した瘻孔内に2cmを超える膿瘍がMRI画像の中央判定で確認された場合。
24週後及び52週後以前の再発までの期間(その他の副次評価項目)
24週後以前の再発までの期間の中央値[95%CI]は、ダルバドストロセル群で19.1週[18.0, 24.0]、プラセボ群で18.0週[13.6, 25.1]であった。
また、52週後以前の再発までの期間の中央値[95%CI]は、ダルバドストロセル群で推定不能、プラセボ群で46.0週[38.1, 47.0]であった。
24週後及び52週後以前の再発までの期間(ITT解析対象集団)
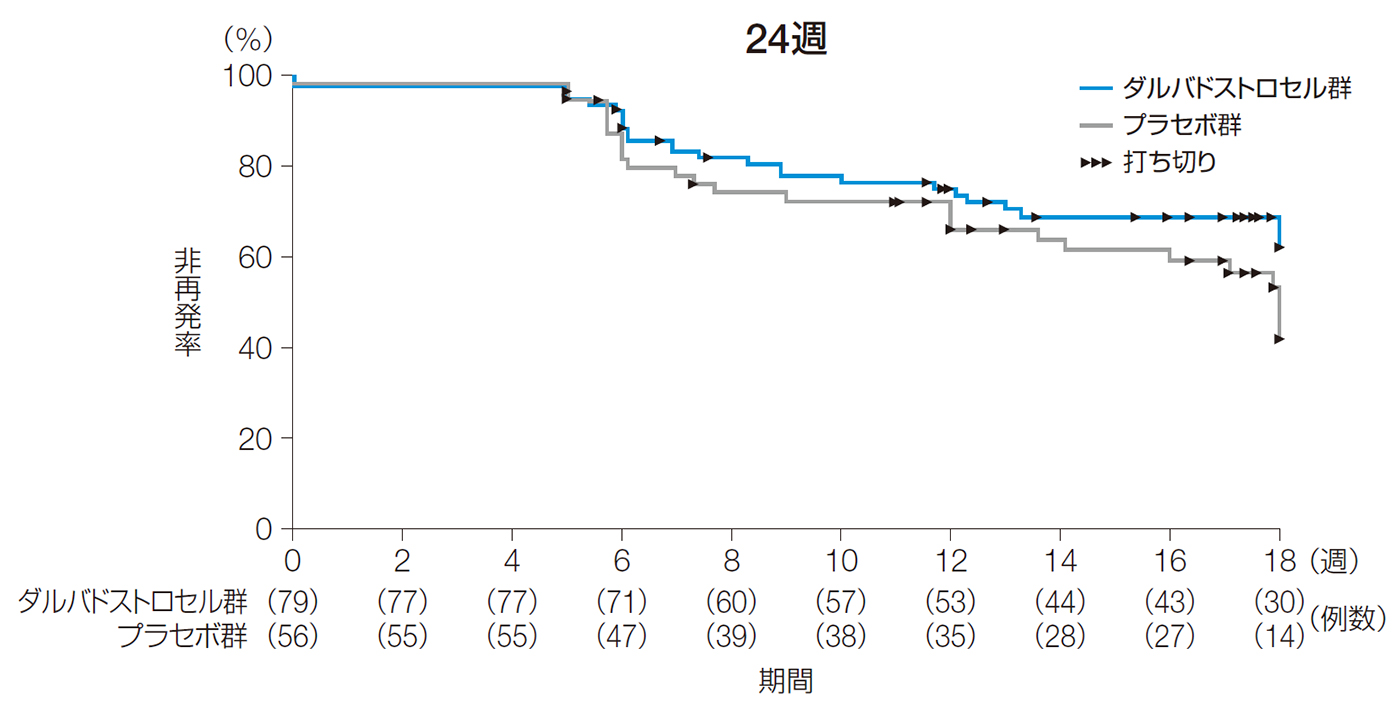
| ダルバドストロセル群 (n=79) |
プラセボ群 (n=56) |
|
|---|---|---|
| 24週後までに 再発 [例数(%)] |
30 (38.0) |
28 (50.0) |
| 24週後までに 再発が 認められず 打ち切り [例数(%)] |
49 (62.0) |
28 (50.0) |
| Kaplan-Meier 法による 再発 までの期間 中央値[95%CI] (週) |
19.1 (18.0, 24.0) |
18.0 (13.6, 25.1) |
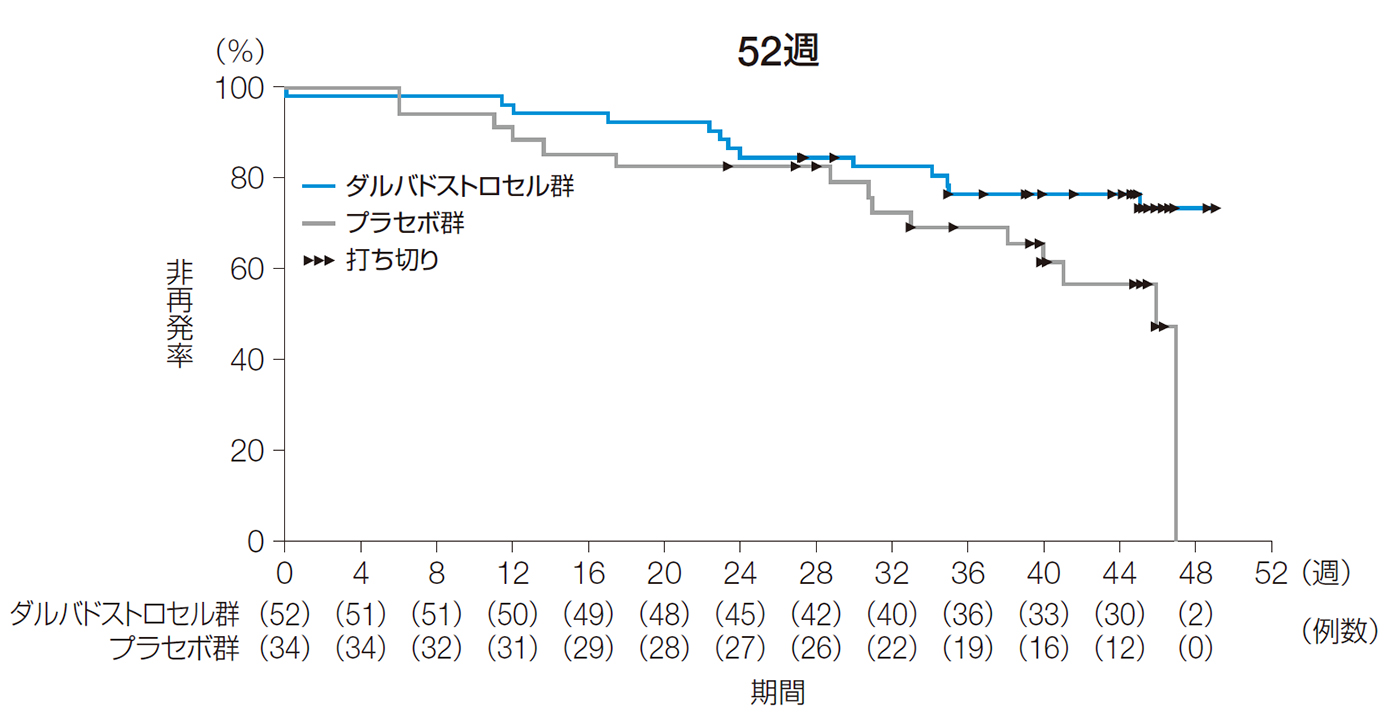
| ダルバドストロセル群 (n=52) |
プラセボ群 (n=34) |
|
|---|---|---|
| 52週後までに 再発 [例数(%)] |
13 (25.0) |
15 (44.1) |
| 52週後までに 再発が 認められず 打ち切り [例数(%)] |
39 (75.0) |
19 (55.9) |
| Kaplan-Meier 法による 再発 までの期間 中央値[95%CI] (週) |
推定不能 | 46.0 (38.1, 47.0) |
【再発までの期間】
24週評価時は24週後より前に臨床寛解を達成した被験者において臨床寛解がみられた最初の来院日、52週評価時は24週後時点で複合寛解を達成した被験者において複合寛解がみられた来院日から、再発がみられた最初の来院日までの期間。
24週後及び52週後のPDAIスコア(その他の副次評価項目)
24週後及び52週後のPDAIスコアのベースラインからの変化量の平均値±標準偏差は、ダルバドストロセル群でそれぞれ−2.32±3.846及び−2.25±4.144、プラセボ群でそれぞれ−1.34±3.523及び−1.43±3.739であった。
24週後及び52週後のPDAIスコアのベースラインからの変化量(ITT解析対象集団)
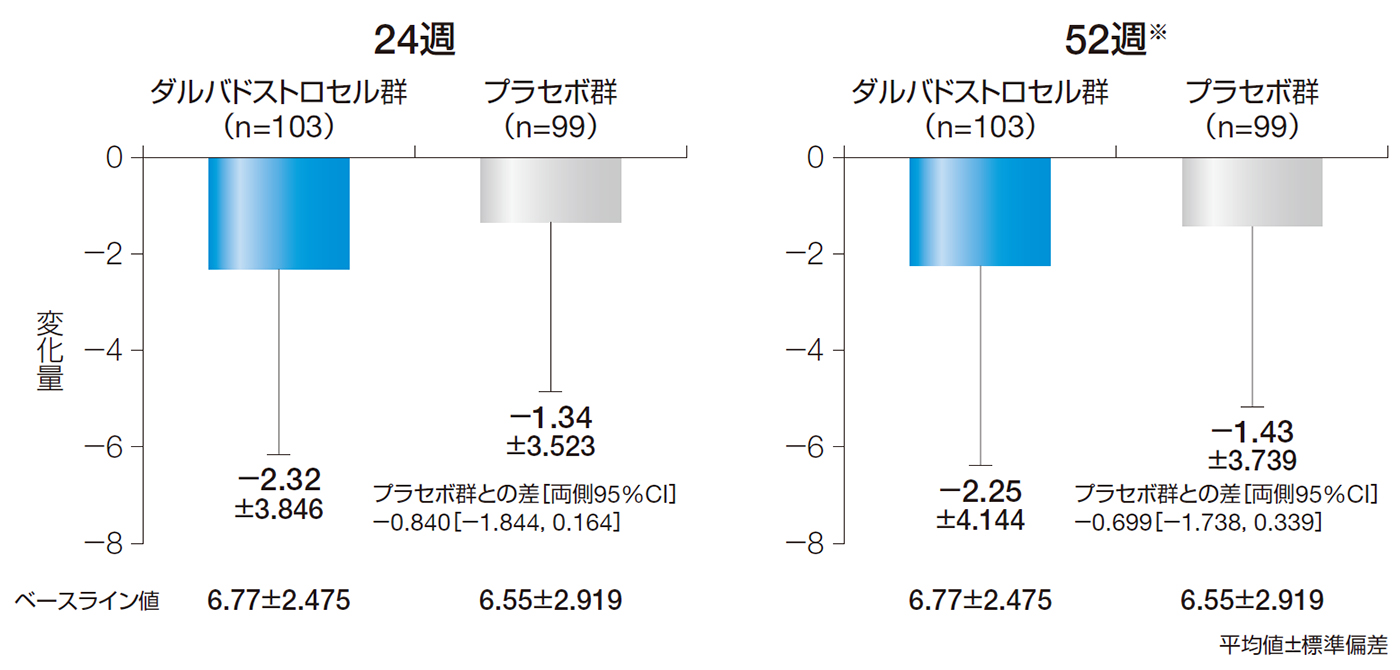
※臨床評価又はMRIデータの欠測がある場合は、LOCFを適用しベースライン以降の最終時点の値を代入した。
【PDAI】
肛門周囲病変活動性指数。5項目([1]排出、[2]痛み/活動制限、[3]性活動の制限、[4]肛門病変のタイプ、[5]硬化の程度)を、0~4の5段階で評価する。点数が高いほど重症度が高い。4)
4)クローン病肛門部病変のすべて -診断から治療まで-(第二版)「難治性炎症性腸管障害に関する調査研究」(鈴木班)
平成30年度 分担研究報告書 別冊, 2019, 40.
24週後及び52週後のCDAIスコア(その他の副次評価項目)
24週後及び52週後のCDAIスコアのベースラインからの変化量の平均値±標準偏差は、ダルバドストロセル群でそれぞれ5.74±62.160及び11.11±80.539、プラセボ群でそれぞれ2.17±65.458及び7.62±67.288であった。
24週後及び52週後のCDAIスコアのベースラインからの変化量(ITT解析対象集団)
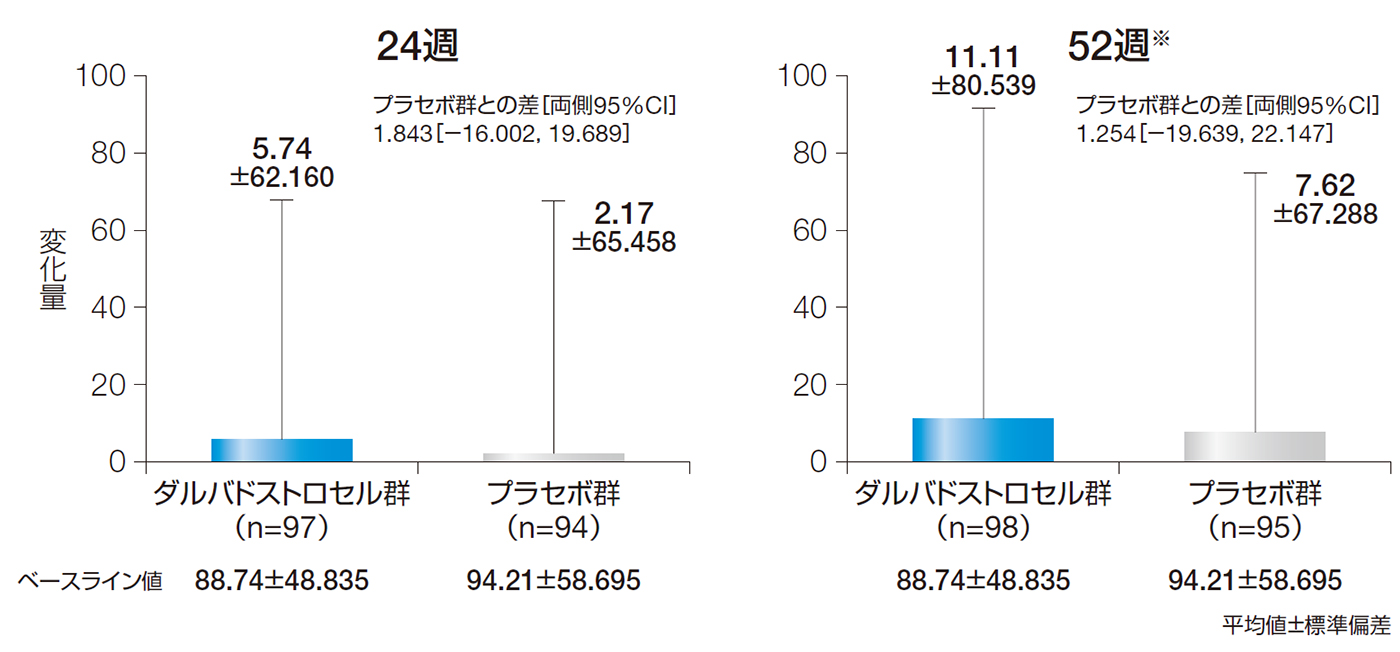
※臨床評価又はMRIデータの欠測がある場合は、LOCFを適用しベースライン以降の最終時点の値を代入した。
【CDAI】
クローン病活動性指数。8項目(軟便・下痢の回数、腹痛、一般状態、関節炎等の有無、下痢に対する服用薬の有無、腹部腫瘤、ヘマトクリット値、体重)について、点数化する。点数が高いほど重症度が高い。5)
5)Best WR, et al.: Gastroenterology 1976; 70(3): 439-444.
24週後及び52週後のVan Asscheスコア(その他の副次評価項目)
24週後及び52週後のVan Asscheスコアのベースラインからの変化量の平均値±標準偏差は、ダルバドストロセル群でそれぞれ−0.44±2.780及び−0.76±3.042、プラセボ群でそれぞれ−0.59±2.332及び−0.63±3.113であった。
24週後及び52週後のVan Asscheスコアのベースラインからの変化量(ITT解析対象集団)
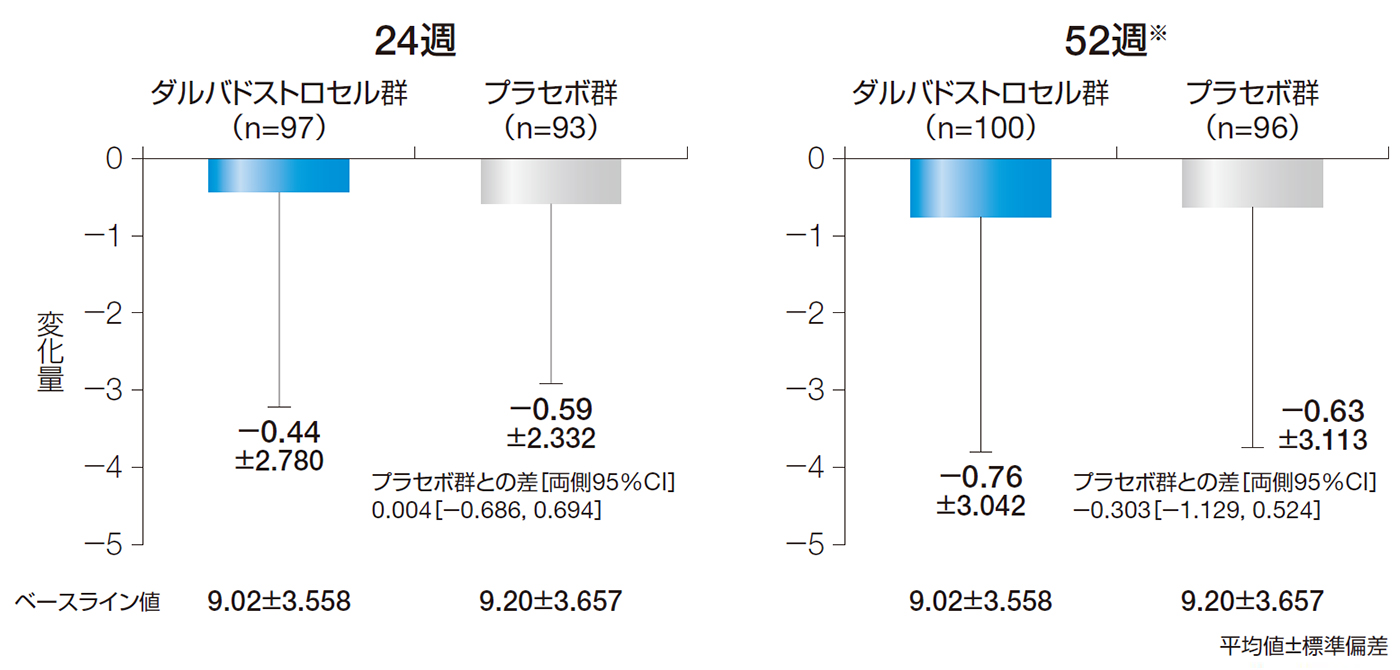
※臨床評価又はMRIデータの欠測がある場合は、LOCFを適用しベースライン以降の最終時点の値を代入した。
【Van Asscheスコア】
クローン病に伴う肛門周囲病変の重症度の指標。MRI画像に基づき、6項目(瘻管の本数、瘻管の位置、瘻管の伸長、T2強調画像の高信号域、膿瘍の有無、直腸壁の病変)で評価する。点数が高いほど重症度が高い。6)
6)Van Assche G, et al.: Am J Gastroenterol 2003; 98(2): 332–339.
24週後及び52週後のIBDQスコア(その他の副次評価項目)
24週後及び52週後のIBDQスコアのベースラインからの変化量の平均値±標準偏差は、ダルバドストロセル群でそれぞれ3.81±25.533及び2.14±27.416、プラセボ群でそれぞれ4.01±25.562及び1.69±25.006であった。
24週後及び52週後のIBDQスコアのベースラインからの変化量(ITT解析対象集団)
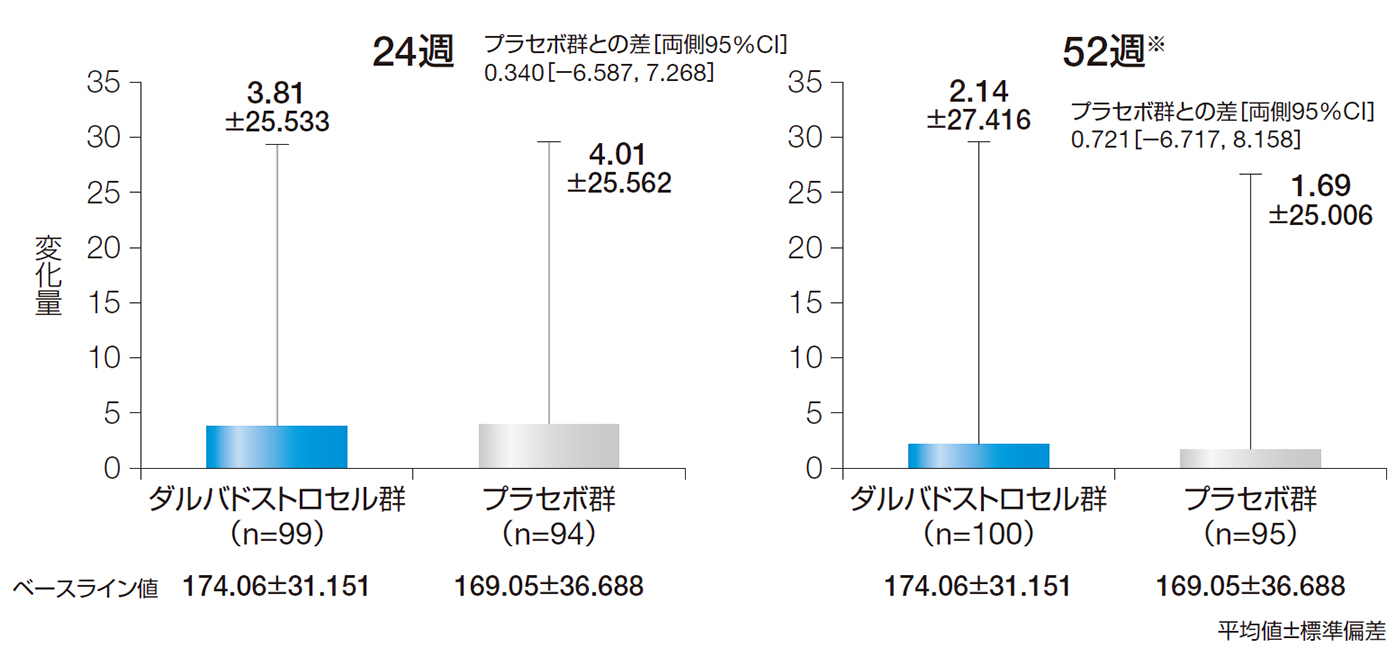
※臨床評価又はMRIデータの欠測がある場合は、LOCFを適用しベースライン以降の最終時点の値を代入した。
【IBDQ】
炎症性腸疾患質問票。クローン病のQOL評価。4つの下位尺度(腹部症状、全身症状、情緒、社会活動 計32項目)について、過去2週間の状態を 「何もない」から「いつも」までの7段階のリッカート尺度を用いて患者が回答する。点数が高いほどQOLがよいとされる。10)
10)Hashimoto H, et al.: J Gastroenterol 2003; 38(12): 1138–1143.
安全性
24週後
投与24週後までに認められた副作用の発現頻度は、ダルバドストロセル群17.5%(18/103例)及びプラセボ群29.4%(30/102例)であった。主な副作用※は、肛門膿瘍〔ダルバドストロセル群5.8%(6例)、プラセボ群 8.8%(9例)〕、肛門周囲痛〔ダルバドストロセル群4.9%(5例)、プラセボ群8.8%(9例)〕であった。
重篤な副作用の発現頻度は、ダルバドストロセル群4.9%(5/103例)及びプラセボ群6.9%(7/102例)であった。その内訳は、ダルバドストロセル群で肛門膿瘍が5例、プラセボ群で肛門膿瘍が5例、肛門周囲痛、肛門の炎症、肝膿瘍が各1例であった。
治験中止に至った副作用の発現頻度は、ダルバドストロセル群2.9%(3/103例)及びプラセボ群4.9%(5/102例)であった。
その内訳は、ダルバドストロセル群で肛門膿瘍が3例、プラセボ群で肛門膿瘍が4例、肛門周囲痛が1例であった。
死亡例は認められなかった。
52週後
投与52週後までに認められた副作用の発現頻度は、ダルバドストロセル群20.4%(21/103例)及びプラセボ群26.5%(27/102例)であった。主な副作用※は、肛門膿瘍〔ダルバドストロセル群7.8%(8例)、プラセボ群8.8%(9例)〕、肛門周囲痛〔ダルバドストロセル群4.9%(5例)、プラセボ群7.8%(8例)〕であった。
重篤な副作用の発現頻度は、ダルバドストロセル群6.8%(7/103例)及びプラセボ群6.9%(7/102例)であった。その内訳は、ダルバドストロセル群で肛門膿瘍が7例、プラセボ群で肛門膿瘍が5例、肛門周囲痛、肛門の炎症、肝膿瘍が各1例であった。
治験中止に至った副作用の発現頻度は、ダルバドストロセル群3.9%(4/103例)及びプラセボ群4.9%(5/102例)であった。
その内訳は、ダルバドストロセル群で肛門膿瘍が3例、肛門周囲痛が1例、プラセボ群で肛門膿瘍が4例、肛門周囲痛が1例であった。
死亡例は認められなかった。
104週後
投与104週後までに認められた副作用の発現頻度は、ダルバドストロセル群19.4%(20/103例)及びプラセボ群26.5%(27/102例)であった。主な副作用※は、肛門膿瘍〔ダルバドストロセル群7.8%(8例)、プラセボ群8.8%(9例)〕、肛門周囲痛〔ダルバドストロセル群4.9%(5例)、プラセボ群7.8%(8例)〕、痔瘻〔ダルバドストロセル群2.9%(3例)、プラセボ群3.9%(4例)〕であった。
重篤な副作用の発現頻度は、ダルバドストロセル群6.8%(7/103例)及びプラセボ群6.9%(7/102例)であった。その内訳は、ダルバドストロセル群で肛門膿瘍が7例、プラセボ群で肛門膿瘍が5例、肛門周囲痛、肛門の炎症、肝膿瘍が各1例であった。
治験中止に至った副作用の発現頻度は、ダルバドストロセル群3.9%(4/103例)及びプラセボ群4.9%(5/102例)であった。
その内訳は、ダルバドストロセル群で肛門膿瘍が3例、肛門周囲痛が1例、プラセボ群で肛門膿瘍が4例、肛門周囲痛が1例であった。
死亡例は認められなかった。
※主な副作用は、ダルバドストロセル群又はプラセボ群のいずれかの群で発現頻度が3%以上であった副作用とした。
24週後、52週後及び104週後までの副作用(安全性解析対象集団)
| 24週後 | 52週後 | 104週後 | ||||
|---|---|---|---|---|---|---|
| 器官別大分類 基本語 |
ダルバドストロセル群 (n=103) |
プラセボ群 (n=102) |
ダルバドストロセル群 (n=103) |
プラセボ群 (n=102) |
ダルバドストロセル群 (n=103) |
プラセボ群 (n=102) |
| 副作用 発現例数 |
18 (17.5) |
30 (29.4) |
21 (20.4) |
27 (26.5) |
20 (19.4) |
27 (26.5) |
| 胃腸障害 | 8 (7.8) |
14 (13.7) |
9 (8.7) |
13 (12.7) |
9 (8.7) |
14 (13.7) |
| 肛門周囲痛 | 5 (4.9) |
9 (8.8) |
5 (4.9) |
8 (7.8) |
5 (4.9) |
8 (7.8) |
| 肛門の炎症 | 0 | 1 (<1.0) |
0 | 1 (<1.0) |
0 | 1 (<1.0) |
| クローン病 | 0 | 1 (<1.0) |
0 | 1 (<1.0) |
0 | 1 (<1.0) |
| 痔瘻 | 2 (1.9) |
1 (<1.0) |
3 (2.9) |
3 (2.9) |
3 (2.9) |
4 (3.9) |
| 痔核 | 1 (<1.0) |
0 | 1 (<1.0) |
0 | 1 (<1.0) |
0 |
| 血便排泄 | 0 | 1 (<1.0) |
0 | 0 | 0 | 0 |
| 直腸炎 | 0 | 1 (<1.0) |
0 | 1 (<1.0) |
0 | 1 (<1.0) |
| 一般・全身 障害および 投与部位の 状態 |
0 | 5 (4.9) |
0 | 4 (3.9) |
0 | 4 (3.9) |
| 倦怠感 | 0 | 1 (<1.0) |
0 | 0 | 0 | 0 |
| 高熱 | 0 | 1 (<1.0) |
0 | 1 (<1.0) |
0 | 1 (<1.0) |
| 発熱 | 0 | 1 (<1.0) |
0 | 1 (<1.0) |
0 | 1 (<1.0) |
| 硬結 | 0 | 2 (2.0) |
0 | 2 (2.0) |
0 | 2 (2.0) |
| 感染症 および 寄生虫症 |
8 (7.8) |
13 (12.7) |
11 (10.7) |
14 (13.7) |
11 (10.7) |
14 (13.7) |
| 肛門膿瘍 | 6 (5.8) |
9 (8.8) |
8 (7.8) |
9 (8.8) |
8 (7.8) |
9 (8.8) |
| 外陰部 腟カンジダ症 |
0 | 1 (<1.0) |
0 | 1 (<1.0) |
0 | 1 (<1.0) |
| 腟膿瘍 | 0 | 1 (<1.0) |
0 | 1 (<1.0) |
0 | 1 (<1.0) |
| 肝膿瘍 | 0 | 1 (<1.0) |
0 | 1 (<1.0) |
0 | 1 (<1.0) |
| 膿瘍 | 0 | 0 | 1 (<1.0) |
0 | 1 (<1.0) |
0 |
| 感染性瘻孔 | 2 (1.9) |
1 (<1.0) |
2 (1.9) |
2 (2.0) |
2 (1.9) |
2 (2.0) |
| 鼻咽頭炎 | 1 (<1.0) |
1 (<1.0) |
0 | 1 (<1.0) |
0 | 1 (<1.0) |
| 尿路感染 | 0 | 0 | 1 (<1.0) |
0 | 1 (<1.0) |
0 |
| 傷害、中毒 および 処置合併症 |
1 (<1.0) |
2 (2.0) |
1 (<1.0) |
2 (2.0) |
1 (<1.0) |
2 (2.0) |
| 処置による疼痛 | 1 (<1.0) |
2 (2.0) |
1 (<1.0) |
2 (2.0) |
1 (<1.0) |
2 (2.0) |
| 臨床検査 | 1 (<1.0) |
0 | 1 (<1.0) |
0 | 1 (<1.0) |
0 |
| アスパラギン酸アミノトランスフェラーゼ増加 | 1 (<1.0) |
0 | 1 (<1.0) |
0 | 1 (<1.0) |
0 |
| 筋骨格系 および 結合組織障害 |
1 (<1.0) |
3 (2.9) |
1 (<1.0) |
3 (2.9) |
1 (<1.0) |
2 (2.0) |
| 瘻孔 | 0 | 1 (<1.0) |
0 | 1 (<1.0) |
0 | 0 |
| 瘻孔分泌物 | 1 (<1.0) |
2 (2.0) |
1 (<1.0) |
2 (2.0) |
1 (<1.0) |
2 (2.0) |
| 生殖系 および 乳房障害 |
1 (<1.0) |
0 | 0 | 0 | 0 | 0 |
| 女性生殖器瘻 | 1 (<1.0) |
0 | 0 | 0 | 0 | 0 |
| 呼吸器、胸郭 および 縦隔障害 |
0 | 1 (<1.0) |
0 | 1 (<1.0) |
0 | 1 (<1.0) |
| 呼吸困難 | 0 | 1 (<1.0) |
0 | 1 (<1.0) |
0 | 1 (<1.0) |
| 胸水 | 0 | 1 (<1.0) |
0 | 1 (<1.0) |
0 | 1 (<1.0) |
| 皮膚および 皮下組織障害 |
0 | 1 (<1.0) |
1 (<1.0) |
1 (<1.0) |
0 | 1 (<1.0) |
| 湿疹 | 0 | 1 (<1.0) |
0 | 1 (<1.0) |
0 | 1 (<1.0) |
| 紅斑 | 0 | 0 | 1 (<1.0) |
0 | 0 | 0 |
MedDRA Ver.17.0(24週後)、Ver.18.0(52週後、104週後)例数(%)
再使用禁止、警告、禁忌・禁止を含む注意事項等情報は
「電子添文」をご参照ください。

