臨床成績
国内第III相臨床試験
(Darvadstrocel-3002試験)2,3)
アロフィセル.jp 医療関係者向けTOP > アロフィセルの基本情報:臨床成績 > 国内第III相臨床試験(Darvadstrocel-3002試験)
国内第III相試験
(Darvadstrocel-3002試験)2)
2)クローン病に伴う複雑痔瘻を対象とした国内第III相臨床試験成績(社内資料、承認審査時評価資料)
3)Furukawa S, et al.: J Crohns Colitis. 2023; 17(3): 369-378.
本試験は武田薬品工業株式会社が実施しているものであり、本論文の著者のうち3名は同社の社員である。
著者に同社よりコンサルタント料等を受領している者が含まれる。
試験概要
| 目的 |
主目的: クローン病に伴う複雑痔瘻治療におけるダルバドストロセルの有効性を24週間にわたり検討する。 副目的: クローン病に伴う複雑痔瘻治療におけるダルバドストロセルの有効性を52週間にわたり、安全性を156週間にわたり検討する。 |
|---|---|
| 試験 デザイン |
多施設共同、非盲検、非対照試験 |
| 対象 | クローン病に伴う複雑痔瘻を有する患者で、以下を満たす患者
|
| 例数 | 22例(ITT解析対象集団) 22例(安全性解析対象集団) |
| 主な 選択基準 |
(1) 非活動期又は軽症のクローン病である者(スクリーニング来院から前処置来院の間に評価したCDAIが220以下と定義する)
(2) 複雑痔瘻を有しており、臨床的評価及びMRIにより原発口が2つ以下、二次口が3つ以下であることが確認された者(すべての二次口は原発口につながっている必要がある)。瘻孔はスクリーニングの6週間以上前から排膿がみられること。複雑痔瘻は、次の1つ以上の基準にあてはまる場合と定義する:
|
| 主な 除外基準 |
(1) スクリーニング来院から前処置来院の間に評価したCDAIが220を超える者、又は直ちに新たな治療の開始が必要な活動性のクローン病を有する者 (2) 直腸膣瘻又は直腸膀胱瘻を合併する者 (3) 3つ以上の原発口又は4つ以上の二次口を有する者 (4) 治験実施計画書で規定したクローン病に伴う複雑痔瘻の治療(抗菌薬、免疫調節薬又は生物学的製剤)を受けたことがない者 (5) 2cmを超える膿瘍がある者 (6) 直腸若しくは肛門の狭窄、又は活動性直腸炎を有する者(外科的手術の制約となる場合) (7) 治療対象の瘻孔に対し、ドレナージ又はシートン留置以外の外科的手術を受けた者 (8) 人工肛門を有する者 等 |
| 投与方法・ 投与量及び 投与期間 |
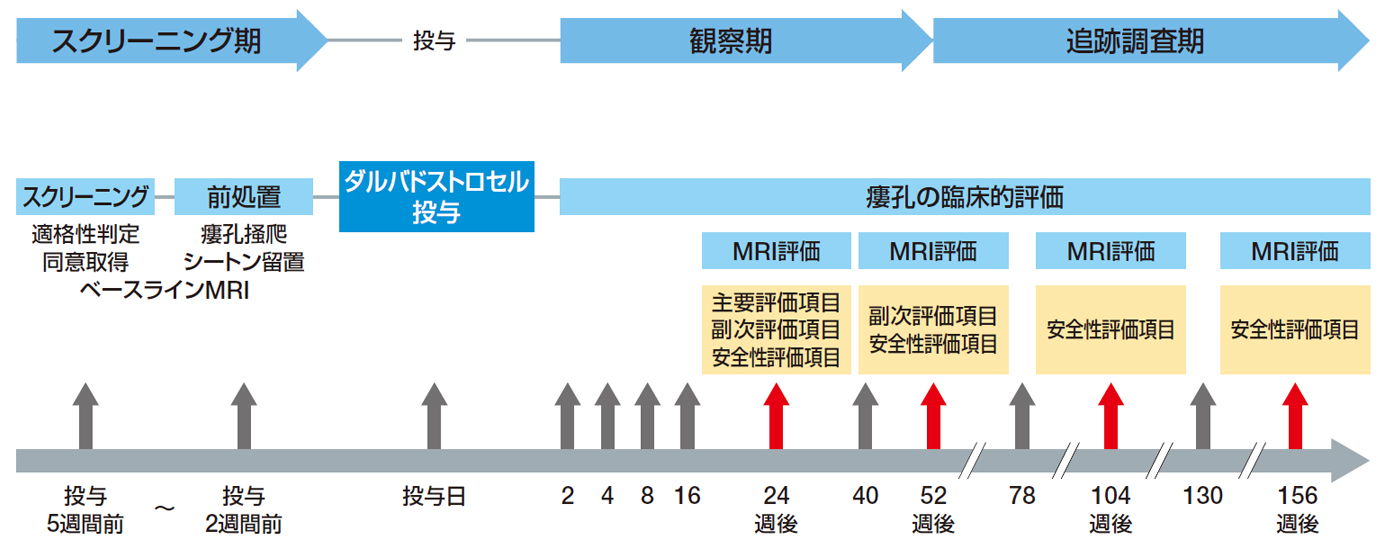
本品投与前の約5週間をスクリーニング期とし、適格性を判定した。さらに、本品投与2週間前までに前処置(麻酔下での診察、瘻孔掻爬及びシートン留置)を行った。留置したシートンは本品投与直前に抜去した。 投与日に120×106個のeASCを含む細胞懸濁液24mL(5×106個/mL)を病変内に単回投与した。その後の観察期では、投与24週後の主要評価項目の評価を含め、有効性及び安全性について52週間にわたり評価することとした。52週後以降の追跡調査期では、26週ごと(6ヵ月ごと)に、156週後まで安全性のフォローアップを行うこととした注1)。 |
試験デザイン
| 主要 評価項目 |
24週後の複合寛解注2)率 |
|---|---|
| 副次 評価項目 |
52週後の複合寛解注2)率、24週後及び52週後の臨床寛解注3)率、改善注4)率、再発注5)率、52週後以前の複合寛解までの期間注6)、24週後及び52週後以前の臨床寛解までの期間注6)、改善までの期間注6)、24週後及び52週後以前の再発までの期間注7)、PDAIスコアのベースラインからの変化量(2、4、8、16、24、40、52週後)、24週後及び52週後のCDAIスコアのベースラインからの変化量、24週後及び52週後のVan Asscheスコアのベースラインからの変化量 |
| 安全性 評価項目 |
有害事象(重篤な有害事象、特に注目すべき有害事象を含む)、本品の不具合、診察所見、バイタルサイン、臨床検査値(血液生化学検査、血液学的検査、尿検査) |
| その他の 評価項目 |
ドナー特異的抗体の有無 |
| 解析計画 | 主要評価項目については、頻度集計を行い、割合及び両側信頼区間(CI)(信頼係数:90%及び95%)を算出した。副次評価項目である52週後の複合寛解率、24週後及び52週後の臨床寛解率、改善率については主要評価項目と同様の解析を行った。また、ベースラインにおける生物学的製剤及び免疫調節薬の併用の有無別のサブグループ解析を行った。臨床評価又はMRIデータの欠測がある場合は、LOCFを適用しベースライン以降の最終時点の値を代入した。 有害事象については、MedDRA/J Ver.23.0を用いて投与群別及び解析対象集団全体で要約した。バイタルサイン及び臨床検査値については、各評価時点の観測値及びベースラインからの変化量を要約した。 |
注1)156週の検討については実施中
注2)複合寛解:ベースライン時に排膿があり、本品を投与したすべての二次口が軽い指押しを行っても排膿がみられず閉鎖したと臨床的に確認され、かつ、本品を投与した瘻孔内に2cmを超える膿瘍がないことがMRI画像の中央判定で確認された場合
注3)臨床寛解:ベースライン時に排膿があり、本品を投与したすべての二次口が軽い指押しを行っても排膿がみられず閉鎖したと臨床的に確認された場合
注4)改善:ベースライン時に排膿があり、本品を投与した二次口のうちの50%以上が軽い指押しを行っても排膿がみられず閉鎖したと臨床的に確認された場合
注5)再発:24週評価時は24週後より前に臨床寛解を達成した被験者、52週評価時は24週後時点で複合寛解を達成した被験者において、本品を投与した二次口のいずれかで排膿を伴う再開通が臨床的に確認された場合、又は本品を投与した瘻孔内に2cmを超える膿瘍がMRI画像の中央判定で確認された場合
注6)複合寛解/臨床寛解/改善までの期間:本品の投与から、複合寛解/臨床寛解/改善がみられた最初の来院日までの期間
注7)再発までの期間:24週評価時は24週後より前に臨床寛解を達成した被験者において臨床寛解がみられた最初の来院日、52週評価時は24週後時点で複合寛解を達成した被験者において複合寛解がみられた来院日から、再発*がみられた最初の来院日までの期間
* 各評価時点の再発の定義に基づく。
[CDAI]クローン病活動性指数、[CI]信頼区間、[eASC]ヒト(同種)脂肪組織由来幹細胞、[LOCF]last observation carried forward、[PDAI]肛門周囲病変活動性指数、[TNF]腫瘍壊死因子
患者背景
| 項目 | カテゴリ | ダルバドストロセル群 (n=22) |
|---|---|---|
| 性別 [例数(%)] |
男性 | 14 (63.6) |
| 女性 | 8 (36.4) |
|
| 年齢(歳) | 平均値± 標準偏差 |
36.4 ± 10.36 |
| 最小値、 最大値 |
19、62 | |
| 年齢(歳) [例数(%)] |
≦65 | 22 (100.0) |
| >65 | 0 | |
| 体重(kg) | 平均値± 標準偏差 |
68.33 ± 23.102 |
| 中央値 (最小値、最大値) |
65.30 (42.7、143.7) |
|
| 身長(cm) | 平均値± 標準偏差 |
166.0 ± 8.28 |
| 中央値 (最小値、最大値) |
168.5 (149、178) |
|
| ベースライン における 生物学的製剤 及び 免疫調節薬 併用 [例数(%)] |
生物学的製剤 のみ併用 |
9 (40.9) |
| 免疫調節薬 のみ併用 |
2 (9.1) |
|
| 生物学的製剤+ 免疫調節薬併用 |
7 (31.8) |
|
| いずれも 併用なし |
4 (18.2) |
|
| クローン病の 罹病期間(年)注1) |
例数 | 22 |
| 平均値± 標準偏差 |
11.3 ± 6.64 |
|
| 最小値、 最大値 |
1、21 | |
| ベースライン における PDAIスコア注2) |
例数 | 22 |
| 平均値± 標準偏差 |
4.8 ± 2.15 |
|
| 最小値、 最大値 |
2、13 | |
| ベースライン における CDAIスコア注3) |
例数 | 22 |
| 平均値± 標準偏差 |
113.55 ± 64.705 |
|
| 最小値、 最大値 |
−10.0、 206.4 |
|
| ベースライン における Van Assche スコア注3) |
例数 | 18 |
| 平均値± 標準偏差 |
14.5 ± 3.99 |
|
| 最小値、 最大値 |
6、22 | |
| 原発口の数 [例数(%)] |
1つ | 16 (72.7) |
| 2つ | 6 (27.3) |
|
| 二次口の数 [例数(%)] |
1つ | 3 (13.6) |
| 2つ | 14 (63.6) |
|
| 3つ | 5 (22.7) |
|
| 原発口及び 二次口の数 [例数(%)] |
原発口が1つ、 二次口が1つ |
3 (13.6) |
| 原発口が1つ、 二次口が2つ |
11 (50.0) |
|
| 原発口が1つ、 二次口が3つ |
2 (9.1) |
|
| 原発口が2つ、 二次口が1つ |
0 | |
| 原発口が2つ、 二次口が2つ |
3 (13.6) |
|
| 原発口が2つ、 二次口が3つ |
3 (13.6) |
注1)(同意取得日-診断日)/365.25により算出した。
注2)0週時点のデータを示した。
注3)スクリーニング時のデータを示した。
有効性
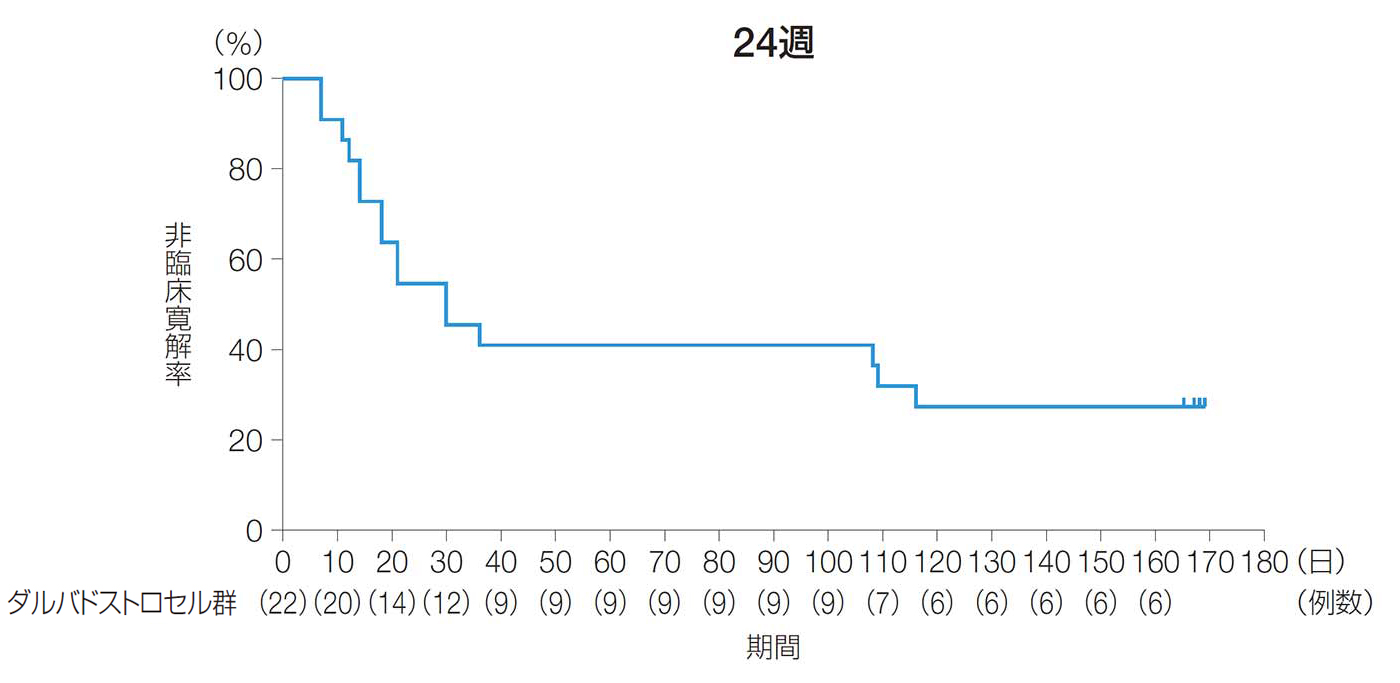
24週後の複合寛解率(主要評価項目)
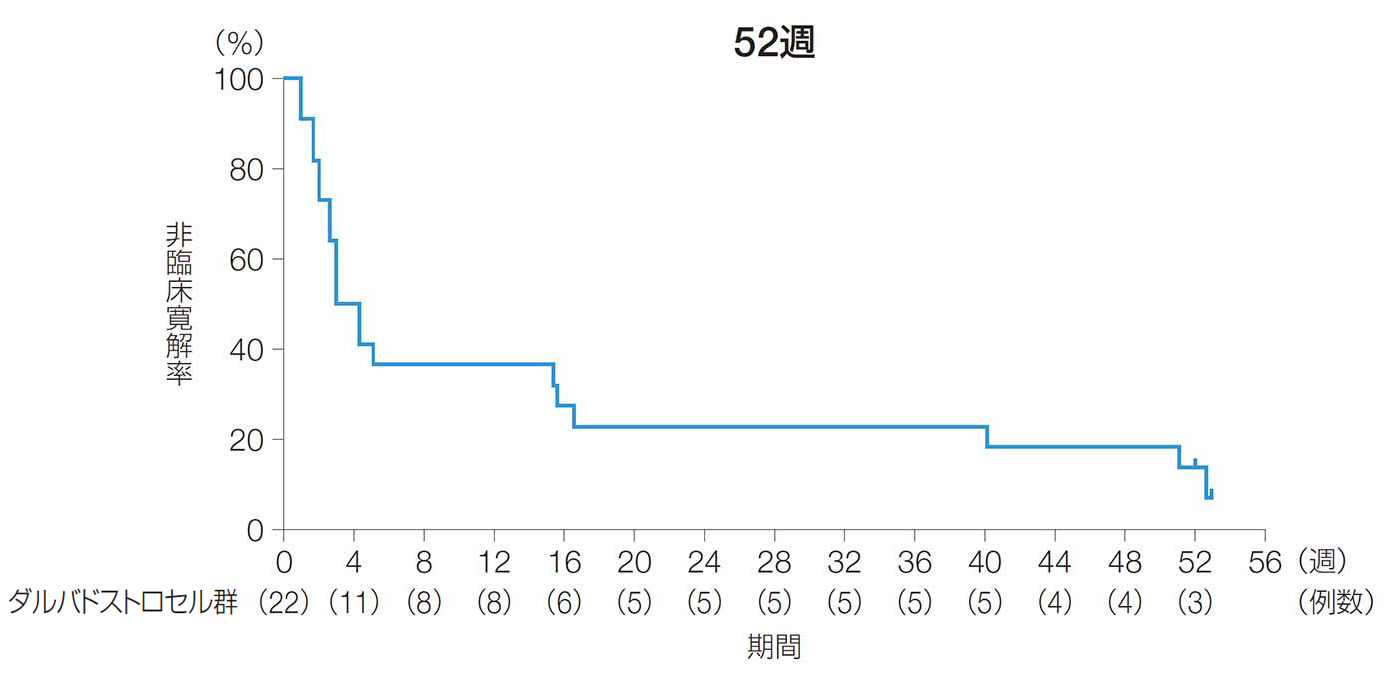
52週後の複合寛解率(副次評価項目)
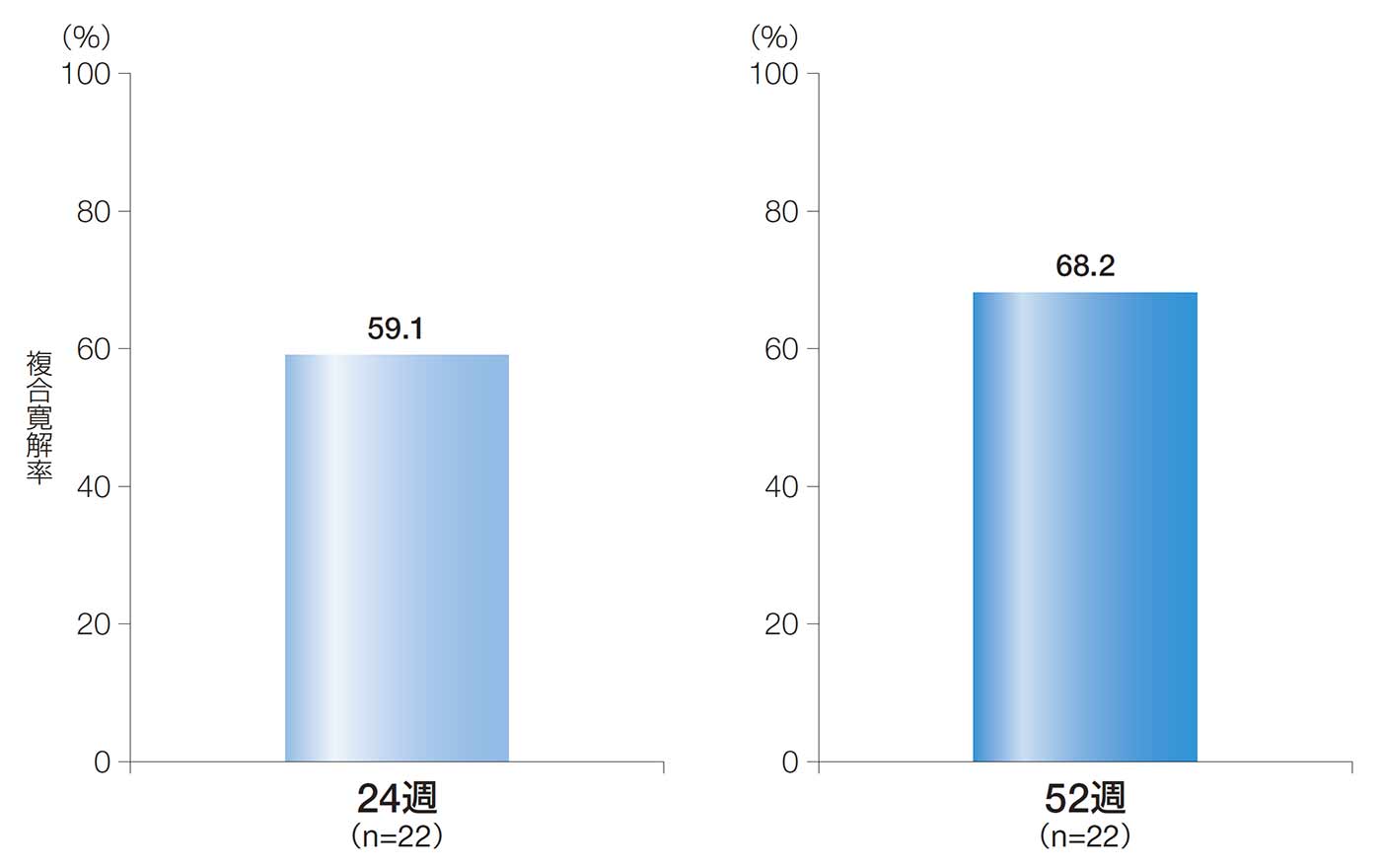
24週後の複合寛解率は、59.1%[90%CI:41.8, 76.3、95%CI:38.5, 79.6]であった。
52週後の複合寛解率は、68.2%[90%CI:51.8, 84.5、95%CI:48.7, 87.6]であった。
24週後及び52週後の複合寛解率(ITT解析対象集団)
臨床評価又はMRIデータの欠測がある場合は、LOCFを適用しベースライン以降の最終時点の値を代入した。
【複合寛解】
ベースライン時に排膿があり、本品を投与したすべての二次口が軽い指押しを行っても排膿がみられず閉鎖したと臨床的に確認され、かつ、治験製品を投与した瘻孔内に2cmを超える膿瘍がないことがMRI画像の中央判定で確認された場合。
52週後以前の複合寛解までの期間(副次評価項目)
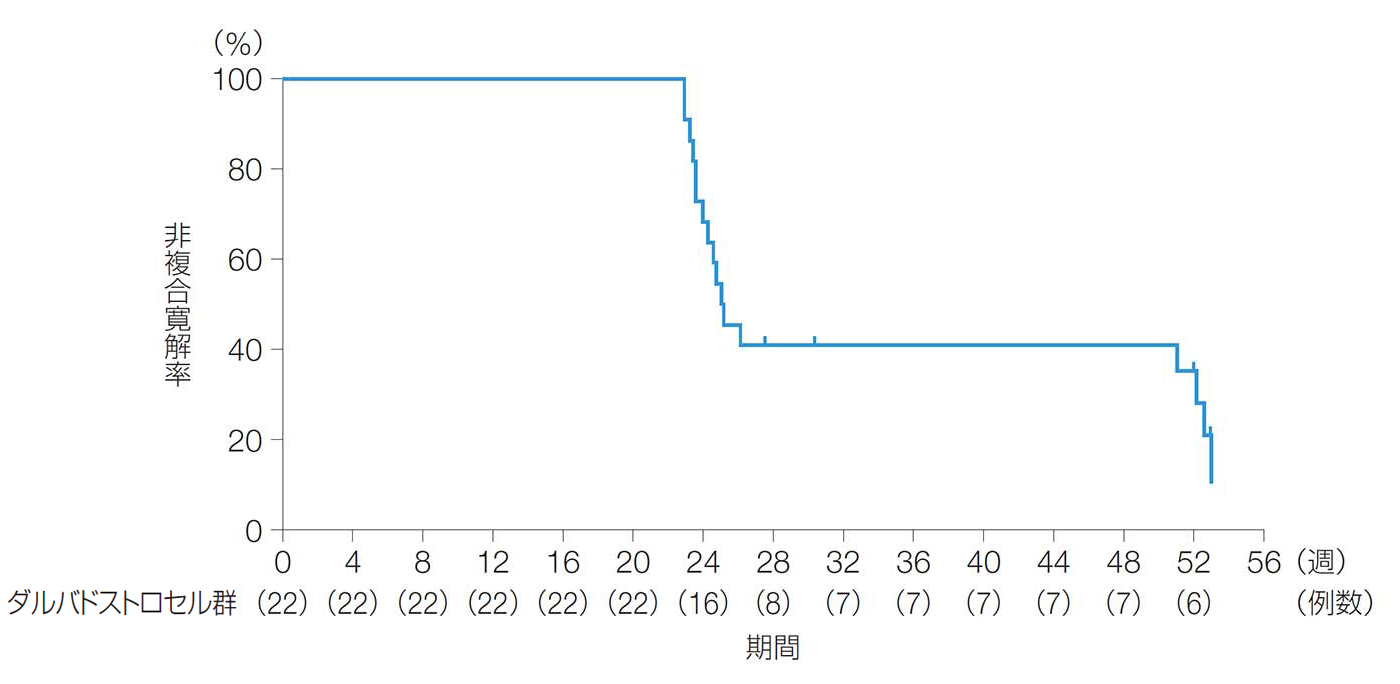
52週後以前の複合寛解までの期間の中央値[95%CI]は、25.1週[23.6, 52.1]であった。
52週後以前の複合寛解率までの期間(ITT解析対象集団)
| ダルバドストロセル群 (n=22) |
|
|---|---|
| 複合寛解までの期間 [中央値(95%CI)] |
25.1週 (23.6、52.1) |
【複合寛解までの期間】
本品の投与から、複合寛解がみられた最初の来院日までの期間。
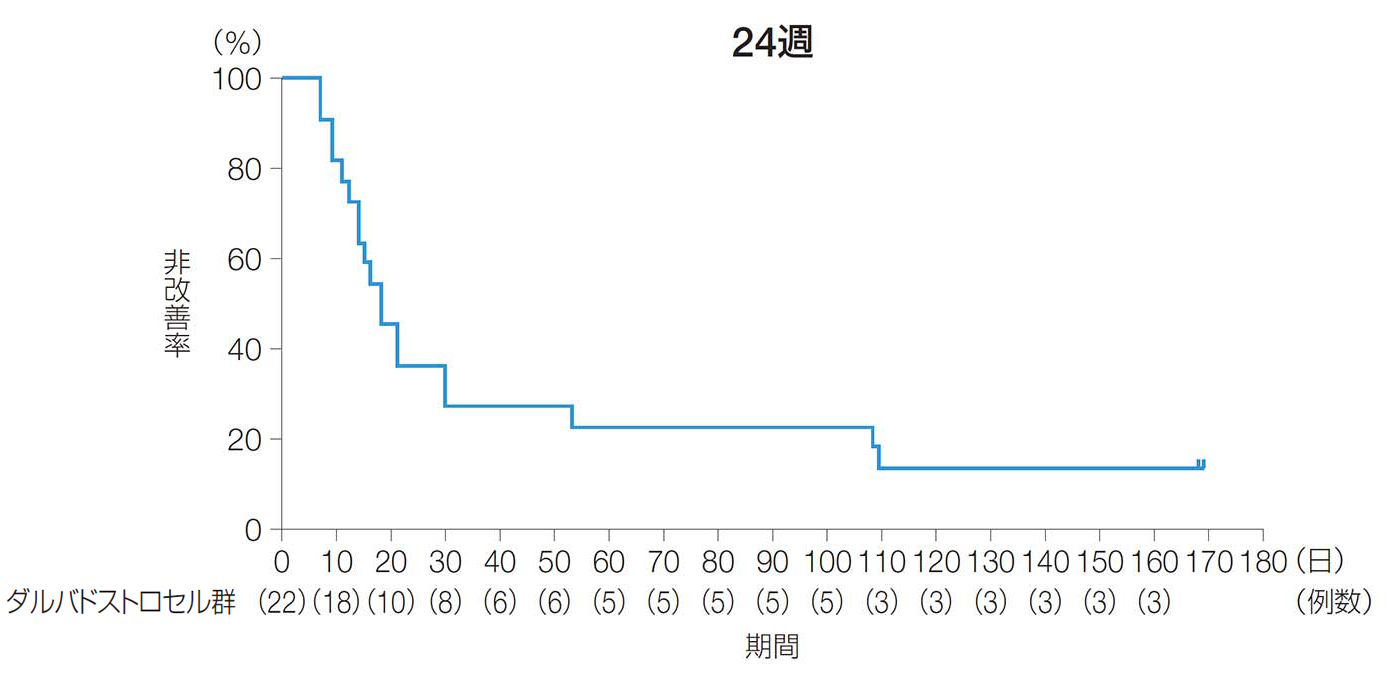
24週後及び52週後の臨床寛解率(副次評価項目)
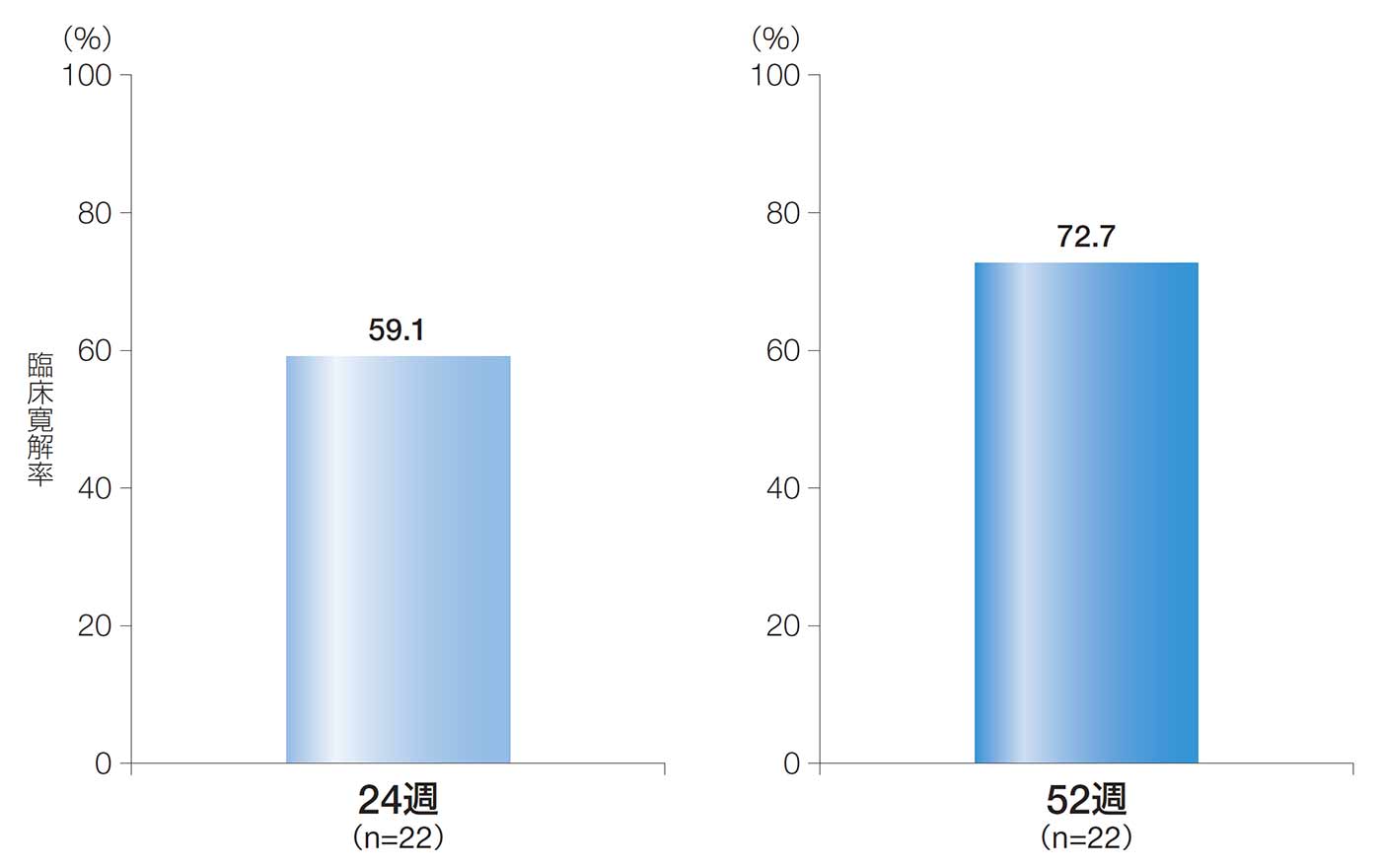
24週後及び52週後の臨床寛解率は、59.1%[90%CI:41.8, 76.3、95%CI:38.5, 79.6]及び72.7%[90%CI:57.1, 88.3、95%CI:54.1, 91.3]であった。
24週後及び52週後の臨床寛解率(ITT解析対象集団)
臨床評価データの欠測がある場合は、LOCFを適用しベースライン以降の最終時点の値を代入した。
【臨床寛解】
ベースライン時に排膿があり、本品を投与したすべての二次口が軽い指押しを行っても排膿がみられず閉鎖したと臨床的に確認された場合。
24週後及び52週後以前の臨床寛解までの期間(副次評価項目)
24週後以前の臨床寛解までの期間の中央値[95%CI]は、30.0日[14.0, 116.0]であった。
52週後以前の臨床寛解までの期間の中央値[95%CI]は、3.7週[2.0, 15.6]であった。
24週後及び52週後以前の臨床寛解までの期間(ITT解析対象集団)
| ダルバドストロセル群 (n=22) |
|
|---|---|
| 臨床寛解までの期間 [中央値(95%CI)] |
30.0日 (14.0、116.0) |
| ダルバドストロセル群 (n=22) |
|
|---|---|
| 臨床寛解までの期間 [中央値(95%CI)] |
3.7週 (2.0、15.6) |
【臨床寛解までの期間】
本品の投与から、臨床寛解がみられた最初の来院日までの期間。
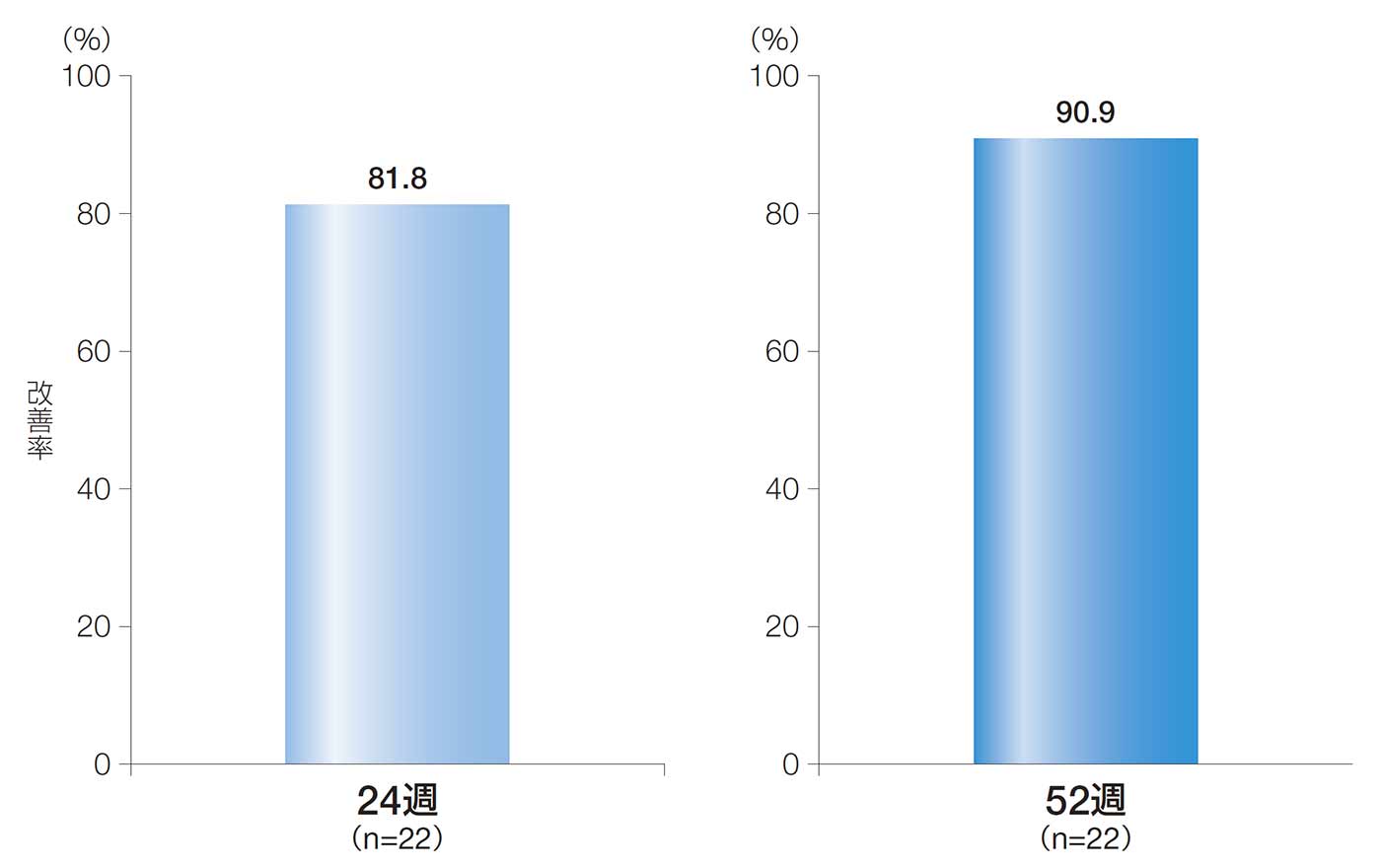
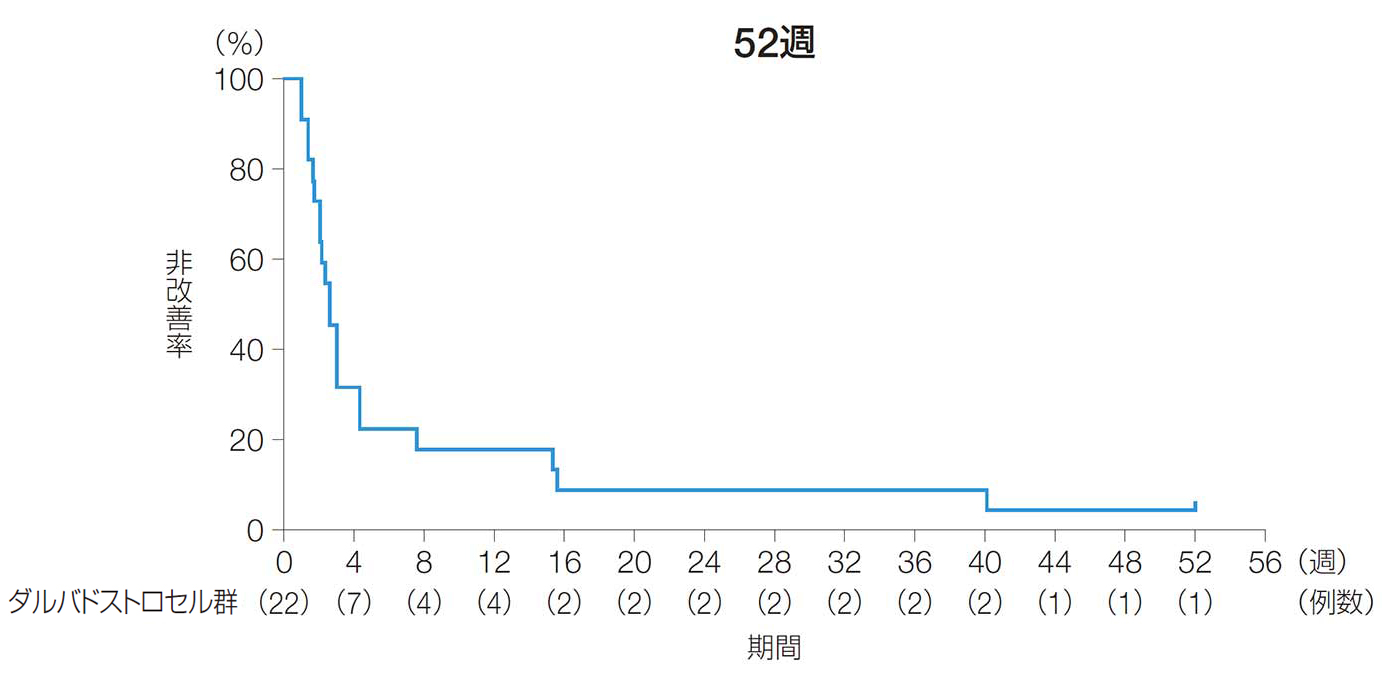
24週後及び52週後の改善率(副次評価項目)
24週後及び52週後の改善率は、81.8%[90%CI:68.3, 95.3、95%CI:65.7, 97.9]及び90.9%[90%CI:80.8, 100.0、95%CI:78.9, 100.0]であった。
24週後及び52週後の改善率(ITT解析対象集団)
臨床評価データの欠測がある場合は、LOCFを適用しベースライン以降の最終時点の値を代入した。
【改善】
ベースライン時に排膿があり、本品を投与した二次口のうちの50%以上が軽い指押しを行っても排膿がみられず閉鎖したと臨床的に確認された場合。
24週後及び52週後以前の改善までの期間(副次評価項目)
24週後以前の改善までの期間の中央値[95%CI]は、18.0日[12.0, 30.0]であった。
52週後以前の改善までの期間の中央値[95%CI]は、2.6週[1.7, 4.3]であった。
24週後及び52週後以前の改善までの期間(ITT解析対象集団)
| ダルバドストロセル群 (n=22) |
|
|---|---|
| 改善までの期間 [中央値(95%CI)] |
18.0日 (12.0、30.0) |
| ダルバドストロセル群 (n=22) |
|
|---|---|
| 改善までの期間 [中央値(95%CI)] |
2.6週 (1.7、4.3) |
【改善までの期間】
本品の投与から、改善がみられた最初の来院日までの期間。
生物学的製剤及び免疫調節薬併用状況別の24週後の複合寛解
(主要評価項目のサブグループ解析)
生物学的製剤及び免疫調節薬併用状況別の24週後の臨床寛解及び改善
(副次評価項目のサブグループ解析)
生物学的製剤及び免疫調節薬併用状況別の24週後に複合寛解、臨床寛解及び改善に至った被検者数は以下のとおりであった。
生物学的製剤及び免疫調節薬併用状況別の24週後の複合寛解、臨床寛解及び改善(ITT解析対象集団、サブグループ解析)
| 併用薬 | 複合寛解 例数 |
臨床寛解 例数 |
改善 例数 |
|---|---|---|---|
| 生物学的製剤のみ (n=9) |
4 | 4 | 6 |
| 免疫調節薬のみ (n=2) |
1 | 1 | 2 |
| 生物学的製剤 +免疫調節薬 (n=7) |
6 | 6 | 7 |
| いずれも併用なし (n=4) |
2 | 2 | 3 |
臨床評価又はMRIデータの欠測がある場合は、LOCFを適用しベースライン以降の最終時点の値を代入した。
【複合寛解】
ベースライン時に排膿があり、本品を投与したすべての二次口が軽い指押しを行っても排膿がみられず閉鎖したと臨床的に確認され、かつ、本品を投与した瘻孔内に2cmを超える膿瘍がないことがMRI画像の中央判定で確認された場合。
【臨床寛解】
ベースライン時に排膿があり、本品を投与したすべての二次口が軽い指押しを行っても排膿がみられず閉鎖したと臨床的に確認された場合。
【改善】
ベースライン時に排膿があり、本品を投与した二次口のうちの50%以上が軽い指押しを行っても排膿がみられず閉鎖したと臨床的に確認された場合。
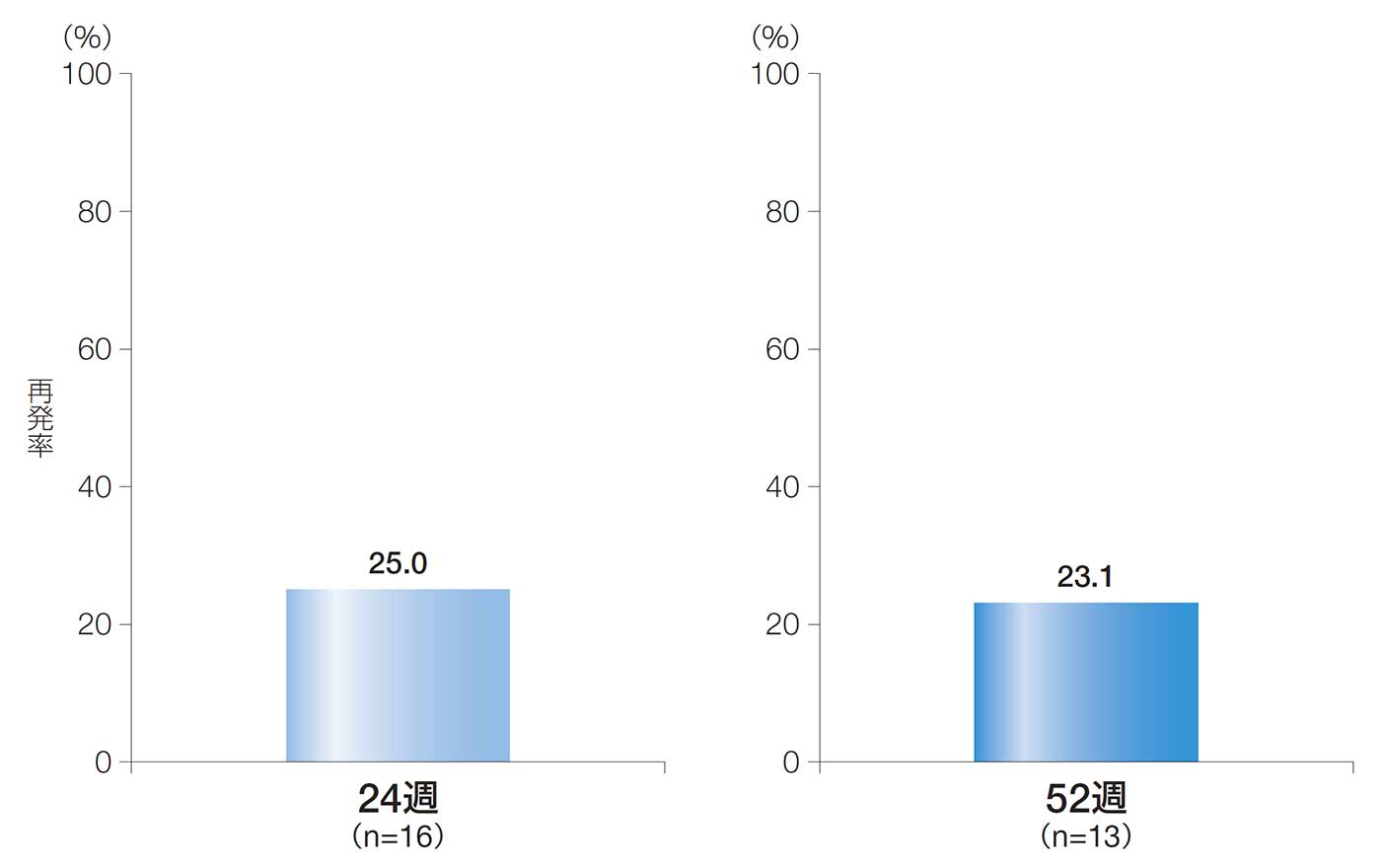
24週後及び52週後の再発率(副次評価項目)
24週後及び52週後の再発率は、25.0%[90%CI:7.2, 42.8、95%CI:3.8, 46.2]及び23.1%[90%CI:3.9, 42.3, 95%CI:0.2, 46.0]であった。
24週後及び52週後の再発率(ITT解析対象集団)
【再発】
24週評価時は24週後より前に臨床寛解を達成した被験者、52週評価時は24週後時点で複合寛解を達成した被験者において、本品を投与した二次口のいずれかで排膿を伴う再開通が臨床的に確認された場合、又は本品を投与した瘻孔内に2cmを超える膿瘍がMRI画像の中央判定で確認された場合。
24週後及び52週後以前の再発までの期間(副次評価項目)
24週後及び52週後以前に再発に至った被験者が少なかったため、再発までの期間の中央値は算出できなかった。
24週後及び52週後以前の再発までの期間(ITT解析対象集団)
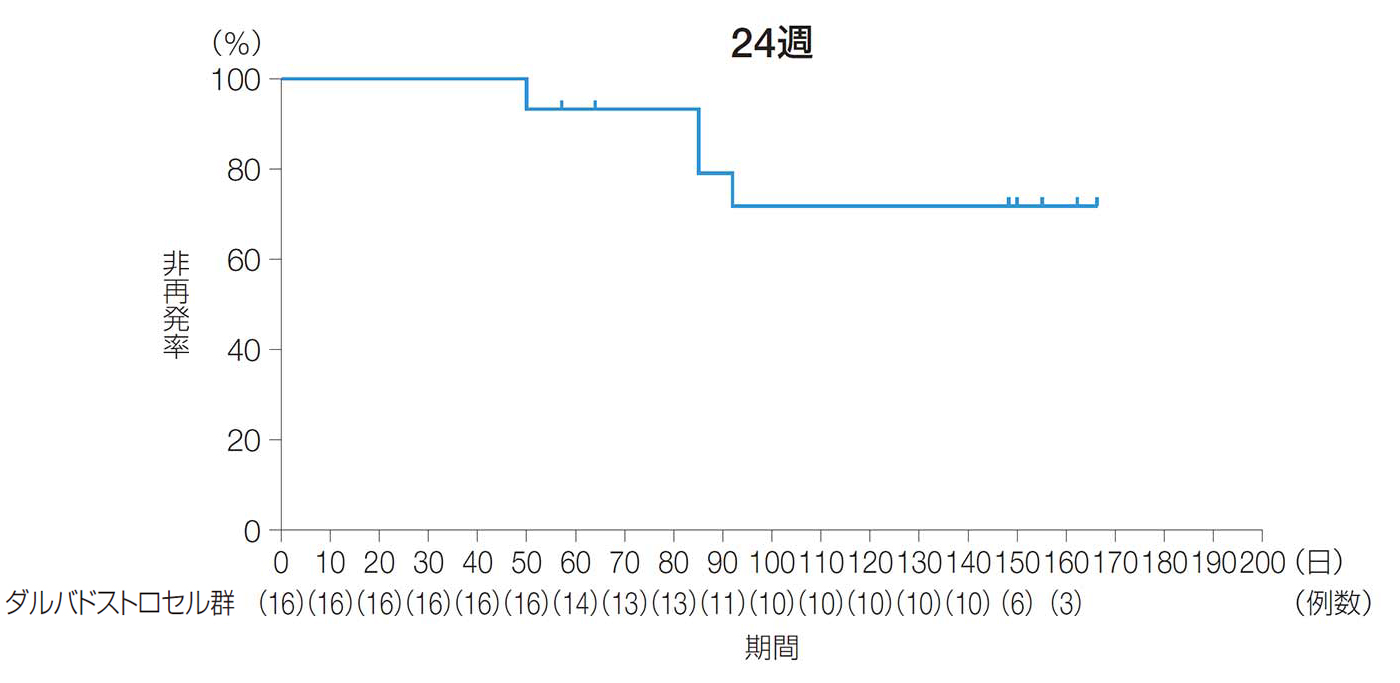
| ダルバドストロセル群 (n=16) |
|
|---|---|
| 再発までの期間 [中央値(95%CI)] |
NA注) |
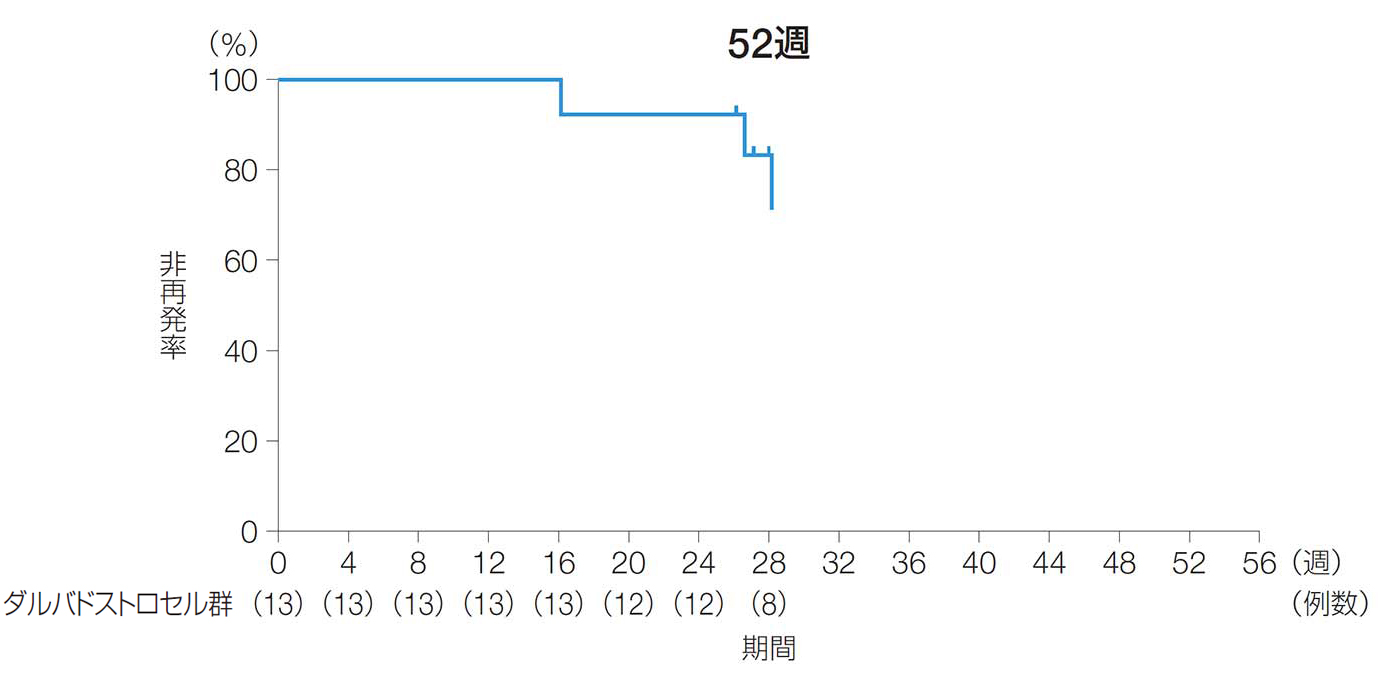
| ダルバドストロセル群 (n=13) |
|
|---|---|
| 再発までの期間 [中央値(95%CI)] |
NA注) |
注)再発に至った被験者が少なかったため、再発までの期間の中央値は算出できなかった。
【再発までの期間】
24週評価時は24週後より前に臨床寛解を達成した被験者において臨床寛解がみられた最初の来院日、52週評価時は24週後時点で複合寛解を達成した被験者において複合寛解がみられた来院日から、再発がみられた最初の来院日までの期間。
[NA]Not Available
PDAIスコアのベースラインからの変化量(2、4、8、16、24、40、52週後)(副次評価項目)
24週後及び52週後のPDAIスコアのベースラインからの変化量の平均値±標準偏差は、−2.4±2.22及び−2.8±2.59であった。
PDAIスコアのベースラインからの変化量(2、4、8、16、24、40、52週後)(ITT解析対象集団)
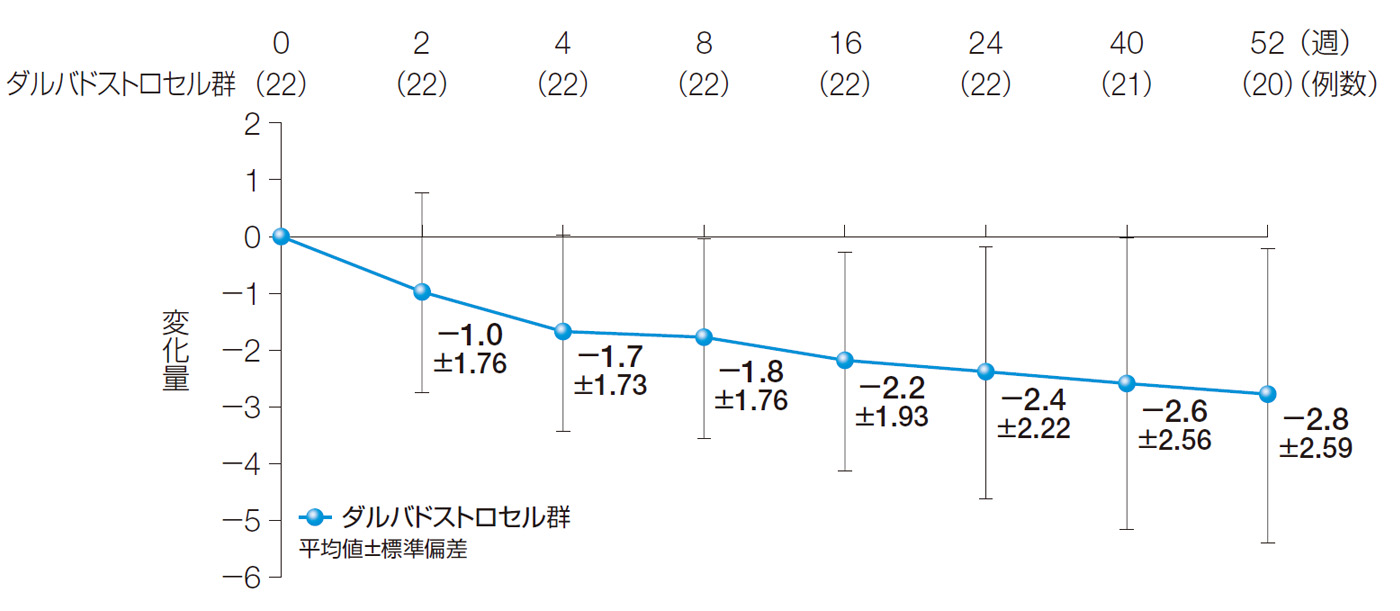
【PDAI】
肛門周囲病変活動性指数。5項目([1]排出、[2]痛み/活動制限、[3]性活動の制限、[4]肛門病変のタイプ、[5]硬化の程度)を、0~4の5段階で評価する。点数が高いほど重症度が高い。4)
4)クローン病肛門部病変のすべて -診断から治療まで-(第二版)「難治性炎症性腸管障害に関する調査研究」(鈴木班)
平成30年度 分担研究報告書 別冊, 2019, 40.
24週後及び52週後のCDAIスコアのベースラインからの変化量(副次評価項目)
24週後及び52週後のCDAIスコアのベースラインからの変化量の平均値±標準偏差は、−5.15±47.500及び−20.86±51.331であった。
24週後及び52週後のCDAIスコアのベースラインからの変化量(ITT解析対象集団)
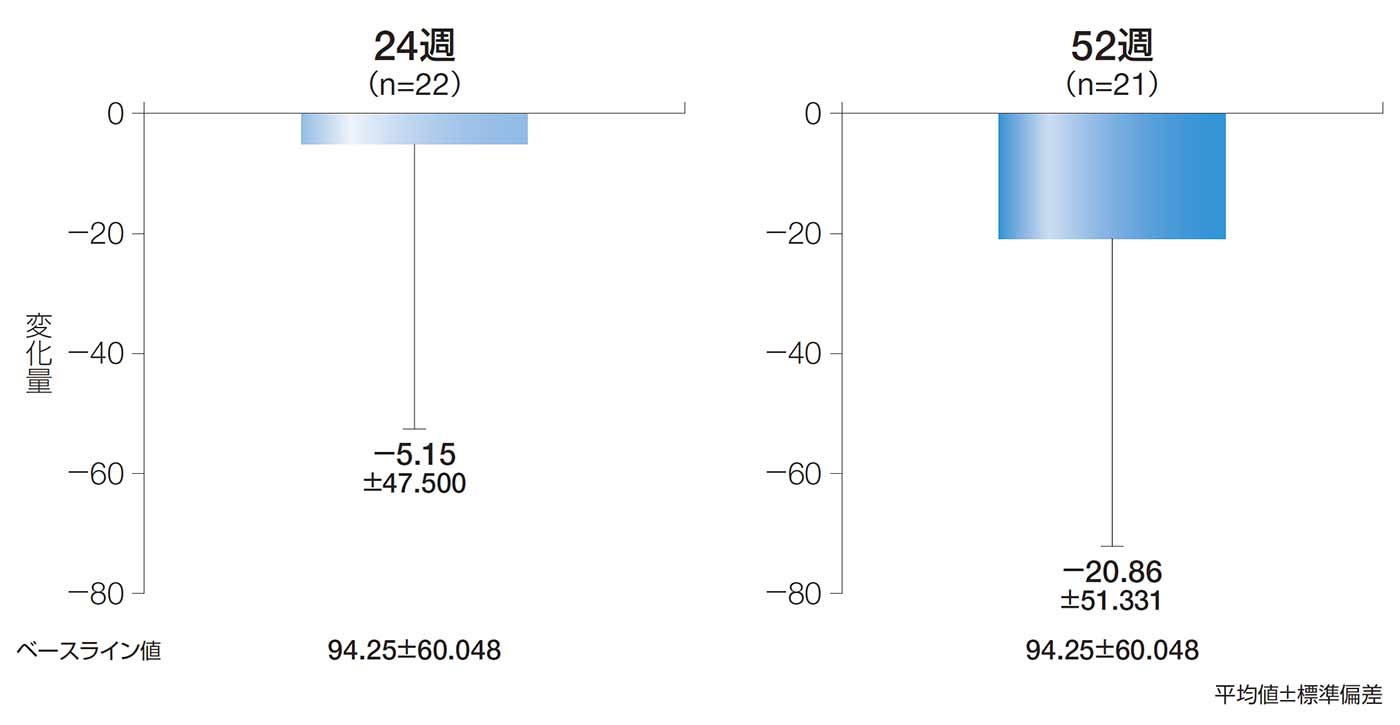
【CDAI】
クローン病活動性指数。8項目(軟便・下痢の回数、腹痛、一般状態、関節炎等の有無、下痢に対する服用薬の有無、腹部腫瘤、ヘマトクリット値、体重)について、点数化する。点数が高いほど重症度が高い。5)
5)Best WR, et al.: Gastroenterology 1976; 70(3): 439-444.
24週後及び52週後のVan Asscheスコアのベースラインからの変化量(副次評価項目)
24週後及び52週後のVan Asscheスコアのベースラインからの変化量の平均値±標準偏差は、−1.7±4.35及び−2.2±4.90であった。
24週後及び52週後のVan Asscheスコアのベースラインからの変化量(ITT解析対象集団)
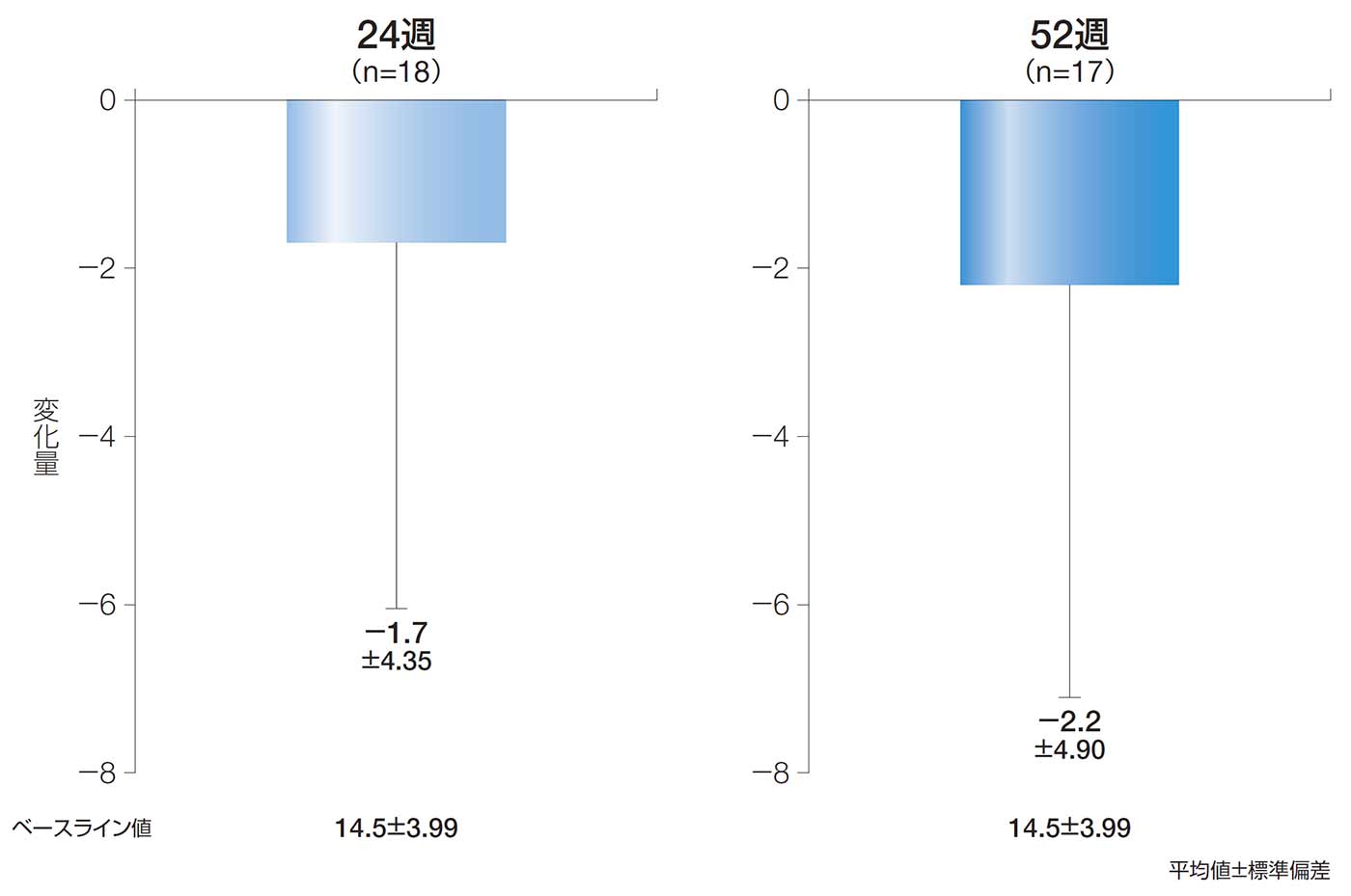
【Van Asscheスコア】
クローン病に伴う肛門周囲病変の重症度の指標。MRI画像に基づき、6項目(瘻管の本数、瘻管の位置、瘻管の伸長、T2強調画像の高信号域、膿瘍の有無、直腸壁の病変)で評価する。点数が高いほど重症度が高い。6)
6)Van Assche G, et al.: Am J Gastroenterol 2003; 98(2): 332–339.
安全性
24週後
投与24週後までに認められた副作用の発現頻度は、4.5%(1/22例)であった。その内訳は、クローン病(症状の悪化)及び下痢が各1例であった。
重篤な副作用の発現頻度は、4.5%(1/22例)であった。その内訳は、クローン病(症状の悪化)が1例であった。
治験中止に至った副作用及び死亡例は認められなかった。
52週後
投与52週後までに認められた副作用の発現頻度は、9.1%(2/22例)であった。その内訳は、クローン病(症状の悪化)、下痢及び血中ビリルビン増加が各1例であった。
重篤な副作用の発現頻度は、4.5%(1/22例)であった。その内訳は、クローン病(症状の悪化)が1例であった。
治験中止に至った副作用及び死亡例は認められなかった。
24週後及び52週後までの副作用(安全性解析対象集団)
| 器官別大分類 基本語 |
24週 (n=22) |
52週 (n=22) |
|---|---|---|
| 副作用 発現例数 |
1(4.5) | 2(9.1) |
| 胃腸障害 | 1(4.5) | 1(4.5) |
| クローン病 | 1(4.5) | 1(4.5) |
| 下痢 | 1(4.5) | 1(4.5) |
| 臨床検査 | 0 | 1(4.5) |
| 血中ビリルビン増加 | 0 | 1(4.5) |
MedDRA/J Ver.23.0例数(%)
再使用禁止、警告、禁忌・禁止を含む注意事項等情報は
「電子添文」をご参照ください。

